Contoh Ikatan Kovalen Polar dan Non Polar, Proses Pembentukan, Pengertian, Soal, Kunci Jawaban, Kepolaran Senyawa, Unsur Kimia - Pernahkah Anda melihat air dengan minyak tidak bercampur satu sama lain? Air dan minyak merupakan suatu senyawa kovalen yang mempunyai kepolaran berbeda. Bagaimana suatu ikatan kovalen suatu senyawa sanggup mensugesti kepolaran? Lakukanlah acara berikut untuk menilik kepolaran suatu senyawa. (Baca juga : Contoh Ikatan Kovalen)
Percobaan Kimia Sederhana :
Kepolaran Senyawa Kovalen
Tujuan :
Menyelidiki kepolaran suatu senyawa yang mempunyai ikatan kovalen
Alat dan Bahan :
- Tabung reaksi sebanyak 3 buah, diberi nomor (1), (2), dan (3)
- Garam dapur (NaCl)
- Air
- Minyak tanah
- Tetraklorometana (CCl4)
Langkah Kerja :
- Isilah tabung reaksi (1) dengan air, kemudian tambahkan padatan garam dapur, kocok, kemudian amati yang terjadi.
- Isilah tabung reaksi (2) dengan minyak tanah, kemudian tambahkan padatan garam dapur, kocok, kemudian amati yang terjadi.
- Isilah tabung reaksi (3) dengan 5 mL air dan 5 mL CCl4, kemudian goyangkan tabung reaksi dan amati.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Apakah yang terjadi dikala NaCl dimasukkan ke dalam air? Larutkah NaCl dalam air?
- Ketika NaCl dimasukkan ke dalam tabung reaksi yang mengandung minyak tanah, apa yang terjadi? Larutkah NaCl dalam minyak tanah?
- Apakah yang terjadi dikala air dan CCl4 dicampurkan?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang diperoleh.
Catatan Kimia :
Sifat yang membedakan senyawa kovalen nonpolar dengan kovalen polar ialah keelektronegatifan. Semakin besar keelektronegatifan pada ikatan kovalen maka semakin besar kepolarannya.
Apa yang Anda peroleh dari acara di atas? Untuk memahaminya, pelajarilah klarifikasi berikut.
Senyawa kovalen dalam bentuk cair banyak dipakai sebagai pelarut dalam kehidupan sehari-hari. Pelarut yang dipakai biasanya ialah air atau pelarut organik. Pelarut organik ini kebanyakan merupakan suatu senyawa kovalen yang gampang menguap dan nonpolar.
Kepolaran suatu senyawa sanggup ditentukan dari perbedaan keelektronegatifan atom-atom yang membentuk suatu senyawa kovalen.
1. Senyawa Kovalen Nonpolar
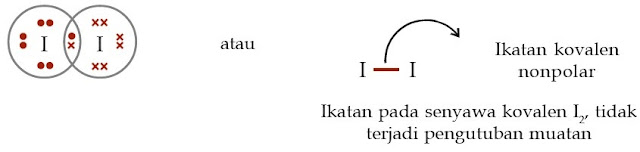
Jika dua atom nonlogam sejenis (diatomik) membentuk suatu senyawa kovalen, misalkan H2, N2, Br2, dan I2 maka ikatan kovalen yang terbentuk mempunyai keelektronegatifan yang sama atau tidak mempunyai perbedaan keelektronegatifan. Ikatan kovalen tersebut dinamakan ikatan kovalen non polar. atau,
Ikatan kovalen nonpolar adalah ikatan kovalen yang Pasangan Elektron Ikatannya (PEI) tertarik sama besar lengan berkuasa ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri. [1]
Ikatan kovalen nonpolar adalah ikatan kovalen yang Pasangan Elektron Ikatannya (PEI) tertarik sama besar lengan berkuasa ke arah atom-atom yang berikatan. Senyawa kovalen nonpolar terbentuk antara atom-atom unsur yang mempunyai beda keelektronegatifan nol atau mempunyai momen dipol = 0 (nol) atau mempunyai bentuk molekul simetri. [1]
Dalam pembentukan molekul I2, kedua elektron dalam ikatan kovalen dipakai secara seimbang oleh kedua inti atom iodin tersebut. Oleh alasannya itu, tidak akan terbentuk muatan (tidak terjadi pengutuban atau polarisasi muatan).
Contoh ikatan polar lainnya: [1]
1) H2
H – H
Keelektronegatifan H = 2,1 maka
Beda keelektronegatifan H2 = 0
µ = 0
Bentuk molekul simetri
2) NH4
Keelektronegatifan 2,1; 2,5
Beda keelektronegatifan = 2,5 – 2,1 = 0,4
µ = d x 1 = 0
Bentuk molekul simetri
2. Senyawa Kovalen Polar
1) H2
H – H
Keelektronegatifan H = 2,1 maka
Beda keelektronegatifan H2 = 0
µ = 0
Bentuk molekul simetri
2) NH4
Keelektronegatifan 2,1; 2,5
Beda keelektronegatifan = 2,5 – 2,1 = 0,4
µ = d x 1 = 0
Bentuk molekul simetri
2. Senyawa Kovalen Polar
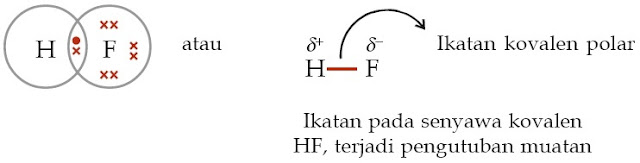
Senyawa kovalen dikatakan polar bila senyawa tersebut mempunyai perbedaan keelektronegatifan. Dengan demikian, pada senyawa yang berikatan kovalen terjadi pengutuban muatan. Ikatan kovalen tersebut dinamakan ikatan kovalen polar. atau
Ikatan kovalen polar ialah ikatan kovalen yang Pasangan Elektron Ikatannya (PEI) cenderung tertarik ke salah satu atom yang berikatan. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol (µ= hasil kali jumlah muatan dengan jaraknya) ≠ 0. [1]
Ikatan kovalen polar ialah ikatan kovalen yang Pasangan Elektron Ikatannya (PEI) cenderung tertarik ke salah satu atom yang berikatan. Senyawa kovalen polar biasanya terjadi antara atom-atom unsur yang beda keelektronegatifannya besar, mempunyai bentuk molekul asimetris, mempunyai momen dipol (µ= hasil kali jumlah muatan dengan jaraknya) ≠ 0. [1]
Dalam pembentukan molekul HF, kedua elektron dalam ikatan kovalen dipakai tidak seimbang oleh inti atom H dan inti atom F sehingga terjadi pengutuban atau polarisasi muatan.
Perbedaan keelektronegatifan atom H dan atom F cukup besar yaitu sekitar 1,9. Perhitungannya ialah sebagai berikut :
H – F
Keelektronegatifan 2,1; 4,0
Beda keelektronegatifan = 4,0 – 2,1 = 1,9
µ = d x 1 = 1,91 Debye
Contoh Ikatan Kovalen Polar Lainnya :
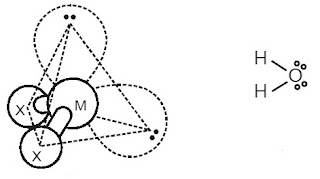
1) H2O
Keelektronegatifan 2,1; 3,5
Beda keelektronegatifan = 3,5 – 2,1 = 1,4
µ = d x l = 1,85 Debye
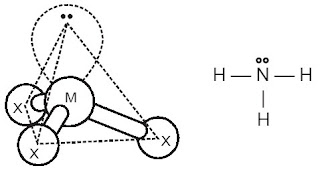
2) NH3
Keelektronegatifan 2,1; 3,0
Beda keelektronegatifan = 3,0 – 2,1 = 0,9
µ = d x l = 1,47 Debye
Senyawa-senyawa lain yang bersifat kovalen polar dan mempunyai perbedaan keelektronegatifan sanggup Anda lihat pada tabel berikut.
Tabel 1. Perbedaan Keelektronegatifan Senyawa
Senyawa | Perbedaan Keelektronegatifan |
HF | 1,9 |
HCl | 0,9 |
HBr | 0,7 |
HI | 0,4 |
Sumber: General Chemistry , 1990 | |
3. Bentuk Molekul yang Mempengaruhi Kepolaran
Dalam suatu molekul poliatomik seperti CCl4, PCl5, BF3, dan BeCl2 terdapat ikatan kovalen polar (dalam ikatan C–Cl, P–Cl, B–F, dan Be–Cl), tetapi molekul-molekul poliatomik tersebut merupakan suatu senyawa
kovalen nonpolar. Mengapa demikian?
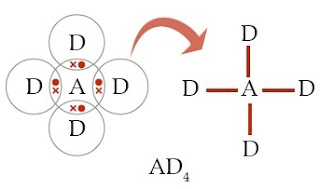
Pada molekul CCl4 terdapat 4 ikatan kovalen polar antara atom sentra C dan 4 atom Cl. Bentuk molekul dari CCl4 adalah simetris (tidak ada pasangan elektron bebas pada struktur molekul Lewisnya) dan tidak terjadi pengutuban atom atau polarisasi muatan alasannya pasangan elektron dalam ikatan dipakai secara seimbang di antara atom sentra C dan 4 atom Cl sehingga molekul CCl4 bersifat nonpolar.
Pada ikatan kovalen yang terdiri lebih dari dua unsur, kepolaran senyawanya ditentukan oleh hal-hal berikut. [3]
1) Jumlah momen dipol, bila jumlah momen dipol = 0, senyawanya bersifat nonpolar. Jika momen dipol tidak sama dengan 0 maka senyawanya bersifat polar. Besarnya momen dipol suatu senyawa sanggup diketahui dengan:
µ = d x l
Di mana:
µ = momen dipol dalam satuan Debye (D)
d = muatan dalam satuan elektrostatis (ses)
l = jarak dalam satuan cm
2) Bentuk molekul, bila bentuk molekulnya simetris maka senyawanya bersifat nonpolar, sedangkan bila bentuk molekulnya tidak simetris maka senyawanya bersifat polar.
Pada ikatan kovalen yang terdiri lebih dari dua unsur, kepolaran senyawanya ditentukan oleh hal-hal berikut. [3]
1) Jumlah momen dipol, bila jumlah momen dipol = 0, senyawanya bersifat nonpolar. Jika momen dipol tidak sama dengan 0 maka senyawanya bersifat polar. Besarnya momen dipol suatu senyawa sanggup diketahui dengan:
µ = d x l
Di mana:
µ = momen dipol dalam satuan Debye (D)
d = muatan dalam satuan elektrostatis (ses)
l = jarak dalam satuan cm
 |
| Momen dipol senyawa polar, µ ≠ 0 [1] |
 |
| Momen dipol senyawa non polar. µ = 0 [1] |
Contoh Soal 1 :
Unsur-unsur atom dengan nomor atom sebagai berikut: A = 6, B = 8, C = 11, D = 17, E = 19. Pasangan unsur-unsur di bawah ini yang sanggup membentuk ikatan kovalen nonpolar ialah ....
A. A dan C
B. B dan C
C. C dan D
D. A dan D
E. D dan E
Kunci Jawaban :
Ikatan kovalen nonpolar terbentuk pada unsur-unsur bukan logam. Melalui konfigurasi elektron sanggup ditentukan jumlah elektron valensi, golongan logam atau nonlogam.
A = 6 (Nomor atom) A: 2 4 (Konfigurasi elektron)
D = 7 (Nomor atom) D: 2 8 7 (Konfigurasi elektron)
Jadi, unsur yang sanggup membentuk ikatan kovalen nonpolar ialah (D) A dan D.
Anda kini sudah mengetahui Ikatan Kovalen Polar dan Ikatan Kovalen Non Polar. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.
Referensi Lainnya :
[1] Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.