Keunikan Sifat / Ciri Khas Atom Karbon, Contoh Soal, Kunci Jawaban - Sebagian besar senyawa kimia yang terdapat di alam ini merupakan senyawa karbon. Atom karbon merupakan salah satu atom yang cukup banyak berada di alam. Keberadaannya dalam bentuk karbon, grafit, maupun intan. Atom karbon mempunyai nomor atom 6 dengan konfigurasi elektron 6C : 1s2 2s2 2p2. Hal ini sanggup terjadi alasannya yaitu sifat atom karbon yang sangat unik. Bagaimanakah sifat atom karbon? Untuk mengetahuinya, lakukanlah aktivitas berikut.
Praktikum / Percobaan Kimia Sederhana 1 :
Keunikan Atom Karbon
Tujuan :
Menyelidiki keunikan atom karbon
Alat dan Bahan :
Tabel Periodik Unsur
Langkah Kerja :
- Gambarkan struktur Lewis atom C.
- Gambarkan struktur Lewis atom O.
- Gambarkan struktur Lewis atom H.
- Gambarkan senyawa yang sanggup terbentuk antara atom C dan atom H.
- Gambarkan ikatan yang terjadi antara atom C dan atom O.
- Gambarkan ikatan yang sanggup terbentuk antara atom C dan atom C.
Jawablah pertanyaan berikut untuk menyimpulkan fakta.
- Berapakah elektron valensi atom C?
- Berapakah jumlah atom yang sanggup diikat atom C?
- Apakah yang terjadi bila atom C berikatan dengan atom O?
- Apakah yang terjadi bila atom C berikatan dengan atom H?
- Apakah yang terjadi bila atom C berikatan dengan atom C?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
Pelajarilah klarifikasi berikut untuk mengetahui keunikan dari atom karbon dan bandingkanlah dengan penelitian Anda pada aktivitas percobaan di atas
1. Atom Karbon Memiliki 4 Elektron Valensi [1]
Berdasarkan konfigurasi keenam elektron yang dimiliki atom karbon didapatkan bahwa elektron valensi yang dimilikinya yaitu 4. Untuk mencapai kestabilan, atom ini masih membutuhkan 4 elektron lagi dengan cara berikatan kovalen. Tidak ada unsur dari golongan lain yang sanggup membentuk ikatan kovalen sebanyak 4 buah dengan hukum oktet.
2. Atom Unsur Karbon Relatif Kecil [1]
Ditinjau dari konfigurasi elektronnya, sanggup diketahui bahwa atom karbon terletak pada periode 2, yang berarti atom ini mempunyai 2 kulit atom, sehingga jari-jari atomnya relatif kecil. Hal ini menjadikan ikatan kovalen yang dibuat relatif berpengaruh dan sanggup membentuk ikatan kovalen rangkap.
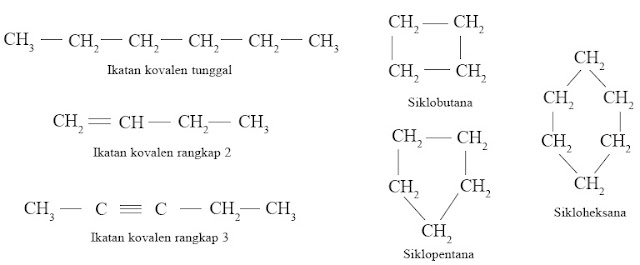
3. Atom Karbon Dapat Membentuk Rantai Karbon [2]
Keadaan atom karbon yang demikian menjadikan atom karbon sanggup membentuk rantai karbon yang sangat panjang dengan ikatan kovalen, baik ikatan kovalen tunggal, rangkap 2, maupun rangkap 3. Selain itu sanggup pula membentuk rantai lingkar (siklik).
4. Atom C Dapat Berikatan dengan Atom H Membentuk Hidrokarbon
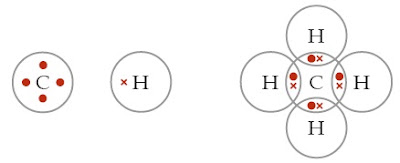
Pada materi, Anda telah mempelajari struktur Lewis suatu atom. Atom C yang berkonfigurasi elektron: 2 4 mempunyai elektron valensi 4. Struktur Lewis atom C sanggup digambarkan sebagai berikut.
Berdasarkan struktur Lewisnya, berapakah jumlah atom H yang sanggup diikat atom C?
Atom C sanggup mengikat 4 atom H membentuk CH4. Senyawa yang terbentuk antara atom C dan atom H disebut hidrokarbon.
5. Atom C Dapat Berikatan dengan Atom O Membentuk Karboksida
Apa yang terjadi bila atom C dan atom O bereaksi? Jawabannya sanggup diketahui dengan melihat struktur Lewis kedua atom. Berikut struktur Lewis atom C dan atom O.
Atom C mempunyai 4 elektron valensi, sedangkan atom O mempunyai 6 elektron valensi. Untuk mencapai kestabilannya, atom C memerlukan 4 elektron, sedangkan atom O memerlukan 2 elektron. Keempat elektron yang diharapkan atom C berasal dari dukungan 2 atom O yang masing-masing menyumbangkan 2 elektron untuk digunakan bersama. Demikian juga dengan atom O yang memerlukan 2 elektron. Setiap atom O mendapat dukungan 2 elektron dari atom C untuk digunakan bersama.
Senyawa yang terbentuk dari hasil reaksi antara atom C dan atom O dinamakan senyawa karboksida.
6. Antaratom C Dapat Saling Berikatan Membentuk Rantai Atom C
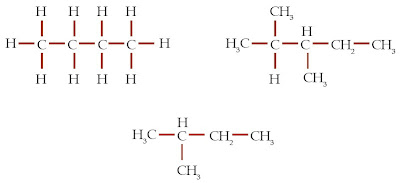
Atom C mempunyai 4 elektron valensi yang memungkinkannya berikatan dengan sesama atom C lainnya. Itulah keunikan atom C sehingga sanggup membentuk rantai karbon yang panjang. Berikut ini contoh-contoh senyawa karbon rantai panjang.
Berdasarkan jumlah atom C yang diikat, ada 4 kemungkinan posisi atom C dalam rantai karbon, yaitu atom C primer, atom C sekunder, atom C tersier, dan atom C kuarterner. Apakah perbedaan antara 4 jenis atom C tersebut?
Atom C primer yaitu atom C yang hanya mengikat 1 atom C lainnya, atom C sekunder yaitu atom C yang mengikat 2 atom C lainnya, atom C tersier yaitu atom C yang mengikat 3 atom C lainnya, sedangkan atom C kuarterner yaitu atom C yang mengikat 4 atom C lainnya. Untuk lebih jelasnya, perhatikanlah referensi soal berikut.
Contoh Soal 1 :
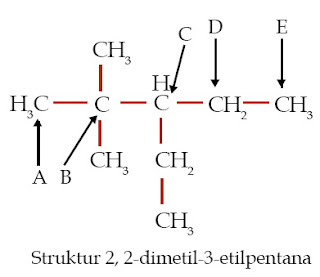
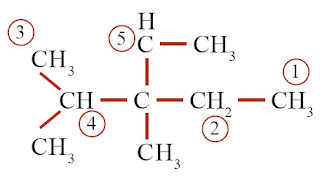
Perhatikan struktur senyawa hidrokarbon berikut.
Atom C yang diberi tanda panah manakah yang merupakan:
a. atom C primer,
b. atom C sekunder,
c. atom C tersier, dan
d. atom C kuarterner.
Kunci Jawaban :
a. atom C primer: A dan E
b. atom C sekunder: D
c. atom C tersier: C
d. atom C kuarterner: B
Contoh Soal 2 :
Dari rumus berikut:
Atom C–primer, C–sekunder, dan C–tersier berturut-turut ditunjukkan oleh nomor ....
A. 5–4–2
B. 4–2–1
C. 3–2–4
D. 1–3–2
E. 1–2–5
Kunci Jawaban :
Atom C primer = atom C yang mengikat 1 atom C yang lain.
Atom C sekunder = atom C yang mengikat 2 atom C.
Atom C tersier = atom C yang mengikat 3 atom C.
Yang termasuk atom C primer yaitu C1 dan C3, atom C sekunder yaitu C2, atom C tersier yaitu atom C4.
Jadi, Atom C–primer, C–sekunder, dan C–tersier berturut-turut yaitu (C) 3–2–4.
Catatan Kimia :
Kotoran Kerbau dan Sampah Organik sebagai Sumber Energi Alternatif
Saat ini, Indonesia telah melirik sumber energi alternatif, yaitu kotoran kerbau dan sampah organik. Sampah organik sisasisa kotoran sayuran dan kotoran kerbau mengandung gas metana (CH4), sisanya karbondioksida dan amonia. Gas metana ini sanggup digunakan sebagai sumber energi alternatif pengganti dari kompor gas. Gas alternatif dari materi organik tersebut dinamakan biogas.
Anda kini sudah mengetahui Ciri Khas Atom Karbon. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Setyawati, A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 186.
[2] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.