fisika-membandingkan-senyawa-dan-unsur" target="_blank">Cara Memprediksi Jenis Ikatan Kimia Berdasarkan Sifat Fisisnya, Membandingkan Senyawa dan Unsur - Pada pembahasan sebelumnya, Anda sudah mempelajari ikatan ion, ikatan kovalen, ikatan kovalen koordinasi, dan ikatan logam. Jenis ikatan dari suatu senyawa memengaruhi sifat fisis senyawa tersebut. Lakukanlah acara berikut semoga Anda bisa memprediksi jenis ikatan pada suatu senyawa.
Percobaan Kimia Sederhana 1 :
Memprediksi Jenis Ikatan Berdasarkan Sifat Fisis Senyawa
Tujuan
Memprediksi jenis ikatan senyawa menurut sifat fisisnya
Alat dan Bahan :
Langkah Kerja
Amatilah data-data percobaan berikut.
Senyawa | Bentuk Senyawa | Perlakuan | Hasil Pengamatan |
NaCl | Padatan | Dipijar beberapa menit | Tidak ada perubahan |
CCl4 | Cairan | Semua cairan menguap | |
H2O | Cairan | Sedikit menguap |
Senyawa | Bentuk Senyawa | Perlakuan | Hasil Pengamatan |
NaCl | Padatan | Larutkan dalam air | Semua larut |
CCl4 | Cairan | Larutkan dalam air | CCl4 tidak larut dengan H2O |
Senyawa | Bentuk Senyawa | Perlakuan | Hasil Pengamatan |
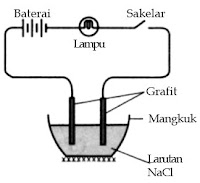
NaCl | Cairan | Simpan dalam wadah, kemudian hubungkan dengan grafit, baterai, dan lampu ibarat gambar berikut. | Lampu pada larutan NaCl menyala. |
CCl4 | Cairan | Perlakuan ibarat pada NaCl | Lampu pada cairan CCl4 tidak menyala. |
Jawablah pertanyaan berikut untuk menyimpulkan fakta.
- Mengapa padatan NaCl tidak mengalami perubahan dikala dipijar beberapa menit?
- Mengapa cairan CCl4 semuanya menguap?
- Mengapa NaCl larut dalam air, sedangkan CCl4 tidak larut?
- Mengapa cairan NaCl sanggup menghantarkan arus listrik?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang diperoleh. Kemudian, presentasikan di depan kelas.
Untuk mengetahui cara memprediksi jenis ikatan menurut sifat fisisnya, pelajarilah klarifikasi berikut.
1. Membandingkan Jenis Ikatan dari Penguapan Senyawa
Natrium klorida merupakan senyawa ion, sedangkan tetraklorometana ialah senyawa kovalen. Natrium klorida tidak gampang menguap sebab mempunyai titik leleh dan titik didih yang tinggi. Tetraklorometana merupakan senyawa yang gampang menguap sebab mempunyai ikatan kovalen nonpolar. Dengan kata lain, tetraklorometana ini mempunyai titik didih yang rendah. Daya tarik antarmolekul senyawa kovalen lemah sehingga molekul-molekulnya gampang dipisahkan melalui pelelehan atau penguapan. Senyawa ion mempunyai ion-ion aktual dan negatif yang terikat oleh gaya elektrostatis yang besar lengan berkuasa sehingga tidak bebas untuk bergerak.
2. Membandingkan Jenis Ikatan dari Kelarutan Senyawa
Jika natrium klorida dilarutkan di dalam air dengan cara mengaduknya, natrium klorida akan larut dalam air. Senyawa ion ibarat natrium klorida sanggup larut dalam air sebab keduanya bersifat polar. Senyawa ion pada umumnya tidak larut pada pelarut organik (pelarut nonpolar). Senyawa kovalen ibarat tetraklorometana merupakan senyawa nonpolar sehingga tidak akan larut dalam air yang bersifat polar. Hal ini menawarkan bahwa senyawa kovalen nonpolar akan larut dalam pelarut nonpolar (organik).
3. Membandingkan Jenis Ikatan dari Daya Hantar Listrik Senyawa
Senyawa ion akan menghantarkan listrik kalau berada dalam bentuk lelehan dan larutan sebab ion aktual dan ion negatifnya sanggup bergerak bebas membawa muatan listrik. Adapun dalam bentuk padatan, senyawa ion tidak sanggup menghantarkan listrik. Berbeda dengan senyawa ion, senyawa kovalen terurai membentuk molekul di dalam air sehingga larutan senyawa kovalen tidak sanggup menghantarkan listrik. Selain itu, lelehan dan padatan senyawa kovalen juga tidak sanggup menghantarkan arus listrik.
4. Sifat Fisis Ikatan Logam
Suatu logam sanggup menghantarkan listrik dan mempunyai titik leleh dan titik didih yang tinggi. Untuk itu, logam merupakan penghantar listrik yang baik. Titik leleh dari logam-logam bervariasi secara periodik. Mulai dari golongan 3 (IIIB) hingga dengan 6 (VIB), titik leleh naik seiring dengan kenaikan jumlah elektron valensi. Adapun dari golongan 6 (VIB) hingga dengan golongan 12 (XIIB), titik leleh semakin menurun seiring dengan kenaikan elektron valensinya. Hal inilah yang menyebabkan mengapa logam Hg mempunyai titik leleh –39 °C sehingga mempunyai wujud cair pada suhu kamar.
Anda kini sudah mengetahui Memprediksi Jenis Ikatan Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.