Perbedaan Sifat Larutan Elektrolit dan Nonelektrolit, Pengertian, Praktikum, Percobaan Kimia - Pengertian Larutan adalah sistem homogen yang terdiri dari zat terlarut (solute) dan pelarut. Pelarut yang sering digunakan dalam melarutkan zat terlarut yaitu air. (solvent). [1] Zat terlarut umumnya jumlahnya lebih sedikit daripada zat pelarut. Contoh larutan gula, larutan garam dapur, larutan alkohol, dan lain sebagainya. Larutan umumnya berfase cair (liquid = l) dengan pelarut air, tetapi ada juga larutan yang berfase padat (solid = s) menyerupai kuningan, stainless steel, dan lain-lain, ataupun gas (g) menyerupai udara.
Contoh Larutan dan Pelarut :
- 25 gram garam dapur dalam 100 gram air; air disebut pelarut, sedangkan garam dapur (NaCl) sebagai zat terlarut.
- Sirup (kadar gula 80 %); gula pasir merupakan komponen paling banyak daripada air akan tetapi gula dinyatakan sebagai zat terlarut dan air sebagai pelarut, alasannya struktur air tidak berubah (wujud: cair), sedangkan gula berubah dari padat menjadi cairan. [2]
Larutan sanggup digolongkan berdasarkan: [2]
- Wujud pelarutnya; yaitu terdiri atas larutan cair (contoh: larutan gula, larutan garam); larutan padat (contoh: emas 22 karat merupakan adonan homogen antara emas dan perak atau logam lain); larutan gas (contoh: udara).
- Daya hantar listriknya; yaitu larutan elektrolit (dapat menhantarkan arus listrik)
- dan larutan non-elektrolit (tidak sanggup menghantarkan arus listrik).
Berdasarkan daya hantar listriknya larutan diklasifikasikan sebagai berikut. [2]
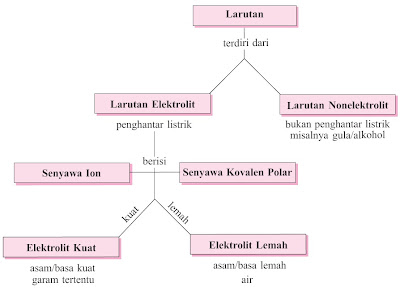 |
| Gambar 1. Klasifikasi larutan menurut daya hantar listriknya. |
Dalam kehidupan kita sehari-hari sering memakai larutan elektrolit dan nonelektrolit. Contoh: [2]
- Baterai untuk jam, kalkulator, handphone, remote control, mainan, dan lain sebagainya. Baterai memakai larutan amonium klorida (NH4Cl), KOH, atau LiOH agar sanggup menghasilkan arus listrik.
- Aki digunakan untuk menstarter kendaraan, memakai larutan asam sulfat (H2SO4).
- Oralit diminum penderita diare supaya tidak mengalami kekurangan cairan tubuh atau kekurangan cairan tubuh. Cairan badan mengandung komponen larutan elektrolit untuk memungkinkan terjadinya daya hantar listrik yang diharapkan impuls saraf bekerja.
- Air sungai dan air tanah mengandung ion-ion. Sifat ini digunakan untuk menangkap ikan dengan memakai setrum listrik.
- Air suling digunakan untuk menciptakan larutan dalam percobaan kimia yaitu nonelektrolit sehingga hanya mengandung sedikit ion-ion.
1. Perbedaan Larutan Elektrolit dan Nonelektrolit
Zat terlarut mempunyai dua sifat menurut perilakunya apabila arus listrik dialirkan. Sifat pertama, zat terlarut sanggup menghantarkan arus listrik, sehingga larutan yang terbentuk mengalami perubahan kimia dan bisa menghantarkan arus listrik. Larutan tersebut dinamakan larutan elektrolit.
"Larutan Elektrolit yaitu suatu zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang sanggup menghantarkan arus listrik. Contohnya air dan alkohol 70 %. Sedangkan larutan non elektrolit tidak menghantarkan arus listrik ketika dilarutkan ke dalam air. Senyawa ionik dan kovalen polar biasanya bersifat elektrolit. Contohnya asam, basa, dan garam.
Sifat kedua, zat yang apabila dilarutkan ke dalam air tidak sanggup menghantarkan arus listrik dan tidak ada perubahan kimia, sehingga larutan yang terbentuk dinamakan larutan nonelektrolit. Semua larutan anorganik, baik asam, basa, maupun garam mempunyai sifat bisa menghantarkan arus listrik. Sedangkan semua larutan yang berasal dari zat organik menyerupai gula tebu, manosa, glukosa, gliserin, etanol, dan urea, tidak bisa menghantarkan arus listrik. [1]
2. Daya Hantar Listrik Larutan
Air yang murni tidak akan menghantarkan listrik. Tetapi jikalau zat yang bersifat asam, basa, maupun garam telah dilarutkan di dalamnya, larutan yang dihasilkan akan bisa menghantarkan arus listrik. Secara sederhana, kemampuan suatu larutan untuk menghantarkan listrik sanggup diuji dengan alat uji elektrolit. Alat uji elektrolit tersebut terdiri atas sebuah ember yang dihubungkan dengan dua buah elektrode. Elektrode-elektrode tersebut dihubungkan pada saklar dan lampu. Jika larutan elektrolit dimasukkan ke dalam ember tersebut, lampu akan menyala. Sedangkan jikalau larutan nonelektrolit yang dimasukkan, lampu tidak akan menyala. Arus listrik dalam larutan elektrolit dihantarkan oleh migrasi partikel-partikel bermuatan.
Selain ditandai dengan menyalanya lampu, pada larutan elektrolit juga terdapat perubahan-perubahan kimia yang sanggup diamati. Salah satu perubahan tersebut berupa timbulnya gelembung-gelembung gas, perubahan warna larutan, atau bahkan terbentuk endapan. [1]
Tabel berikut menyajikan rujukan pengujian daya hantar listrik dari beberapa larutan. [1, 2]
Tabel 1. Contoh pengujian daya hantar listrik dari beberapa larutan.
No. | Larutan yang Diuji | Rumus Kimia | Pengamatan | |
Nyala Lampu | Elektrode | |||
1. | Air suling | H2O | - | - |
2. | Alkohol 70% | C2H5OH | - | - |
3. | Asam sulfat | H2SO4 | menyala terang | ada gelembung gas |
4. | Natrium hidroksida | NaOH | menyala terang | ada gelembung gas |
5. | Asam cuka | CH3COOH | tidak menyala | ada gelembung gas |
6. | Amonium hidroksida | NH4OH | tidak menyala | ada gelembung gas |
7. | Larutan gula | C12H22O11 | tidak menyala | tidak ada gelembung |
8. | Larutan urea | CO(NH2)2 | tidak menyala | tidak ada gelembung |
9. | Garam dapur | NaCl | menyala terang | ada gelembung gas |
Dari data tabel 1, tampak bahwa:
- Arus listrik yang melalui larutan asam sulfat, natrium hidroksida, dan garam dapur sanggup mengakibatkan lampu menyala terang dan timbul gas di sekitar elektrode. Hal ini menawarkan bahwa larutan asam sulfat, natrium hidroksida, dan garam dapur mempunyai daya hantar listrik yang baik.
- Arus listrik yang melalui larutan asam cuka dan amonium hidroksida mengakibatkan lampu tidak menyala, tetapi pada elektrode timbul gas. Hal ini menawarkan bahwa larutan asam cuka dan amonium hidroksida mempunyai daya hantar listrik yang lemah.
- Arus listrik yang melalui larutan gula dan larutan urea tidak bisa menyalakan lampu dan juga tidak timbul gas pada elektrode. Hal ini menawarkan bahwa larutan gula dan larutan urea tidak sanggup menghantarkan listrik.
Senyawa kovalen nonpolar biasanya nonelektrolit. Molekul air bermuatan netral tetapi mempunyai ujung positif (atom H) dan ujung negatif (ujung O) sehingga sangat efektif melarutkan senyawa ionik atau senyawa kovalen polar.
Molekul-molekul air menstabilkan ion-ion dalam larutan dengan mengelilingi ion-ion tersebut, sehingga kation tidak bergabung kembali dengan anion. Proses di mana sebuah ion dikelilingi oleh molekul-molekul air yang tersusun dalam keadaan tertentu disebut hidrasi. Contoh padatan NaCl akan terionisasi menghasilkan Na+ dan Cl– saat dilarutkan dalam air. [3]
Ion Na+ akan tertarik ke elektrode negatif dan ion Cl– tertarik ke elektrode positif sehingga menghasilkan arus listrik yang setara dengan aliran elektron sepanjang kawat penghantar (kabel). [3]
H2O | ||||
NaCl(s) | → | Na+(aq) | + | Cl–(aq) |
Berdasarkan berpengaruh lemahnya daya hantar listrik, elektrolit dibagi dua yaitu elektrolit berpengaruh dan elektrolit lemah. Suatu zat yang mempunyai daya hantar listrik berpengaruh termasuk elektrolit kuat, dan zat yang daya hantar listriknya lemah termasuk elektrolit lemah. Larutan elektrolit berpengaruh misalnya asam kuat (HCl, HBr, HI, H2SO4, HNO3), basa berpengaruh (NaOH, KOH, LiOH, Ca(OH)2, Ba(OH)2), dan garam (NaCl, KCl, CaCl2, BaBr2, CaSO4, dan lain-lain). Larutan-larutan ini terionisasi tepat dalam air (α = 1), sehingga semua molekul terdisosiasi dan tidak ada molekul tersisa dalam larutan.
Berbeda dengan larutan elektrolit lemah yang terionisasi sebagian (0 < α < 1), dalam larutan sebagian berbentuk ionion sebagian lagi masih dalam bentuk molekul. Contoh dalam cuka mengandung asam asetat (CH3COOH) yang terionisasi sebagian:
Awalnya sejumlah molekul CH3COOH terurai menjadi ion-ion CH3COO– dan H+. Seiring berjalannya waktu beberapa ion CH3COO– dan H+ bergabung kembali membentuk molekul CH3COOH. Contoh elektrolit lemah yaitu asam lemah (CH3COOH, H3PO4, HCOOH, HCN, HF, H2S, dan lain-lain) dan basa lemah (NH4OH, Fe(OH)3, Al(OH)3, dan lain-lain).
Larutan nonelektrolit tidak sanggup terionisasi (α = 0), sehingga tidak ada ion dalam larutan tetapi semua dalam bentuk molekul. Contoh larutan nonelektrolit yaitu larutan urea dan larutan glukosa. Secara kuantitatif, berpengaruh lemahnya larutan elektrolit sanggup diukur dari α = derajat disosiasi (untuk senyawa ion)/derajat ionisasi (untuk senyawa kovalen polar).
α = jumlah mol zat yang terurai / jumlah mol zat mula - mula
Perbedaan larutan elektrolit kuat, elektrolit lemah, dan nonelektrolit menyerupai dalam tabel berikut.
Tabel 1. Perbedaan larutan elektrolit kuat, elektrolit lemah, dan nonelektrolit
Jenis larutan | Jenis zat terlarut | Tes nyala lampu | Tes elektrode |
Elektrolit berpengaruh | Senyawa ion (lelehan dan larutan) dan senyawa kovalen polar (larutan) yang terionisasi tepat (α = 1) | Terang | Terbentuk banyak gelembung gas |
Elektrolit lemah | Senyawa kovalen polar yang terionisasi sebagian (0 < α < 1) | Redup | Terbentuk sedikit gelembung gas |
Nonelektrolit | Senyawa kovalen polar yang tidak terionisasi (α = 0) | Tidak menyala | Tidak terbentuk gelembung gas |
Lakukanlah Praktikum / Percobaan Kimia Sederhana di Bawah ini untuk memperjelas materi di atas. [3]
Bentuklah kelompok kerja yang masing-masing kelompok beranggotakan 3 orang siswa, kemudian lakukan eksperimen di bawah ini secara berkelompok. Setelah selesai melaksanakan eksperimen, diskusikan hasil pengamatan yang diperoleh dan jawablah pertanyaan yang diberikan.
Uji Daya Hantar Listrik
Tujuan:
Setelah melaksanakan eksperimen ini, Anda diharapkan:
- Terampil merangkai alat uji daya hantar listrik larutan.
- Dapat melaksanakan pengamatan tanda-tanda hantaran arus listrik pada beberapa larutan.
- Dapat membedakan antara larutan elektrolit dan nonelektrolit.
- Dapat menjelaskan pengertian larutan elektrolit dan nonelektrolit.
Alat dan bahan:
- batu baterai (sumber arus) 4. elektode karbon
- bola lampu 5 watt 5. beberapa macam larutan
- kabel
Prosedur eksperimen:
1. Rangkailah alat uji daya hantar listrik sehingga sanggup berfungsi dengan baik!
2. Ambillah masing-masing 50 mL larutan yang akan diuji daya hantarnya dan masukkan ke dalam gelas kimia yang telah diberi label!
No. | Jenis Larutan | Rumus Kimia |
a. b. c. d. e. f. g. h. i. j. | Larutan asam sulfat 0,1 M Larutan garam dapur Larutan asam cuka 0,1 M Air sumur Larutan kalsium hidroksida 0,1 M Air jeruk Larutan gula Air hujan Larutan asam klorida 0,1 M Larutan amonium hidroksida 0,1 M | H2SO4 NaCl CH3COOH H2O Ca(OH)2 - C6H12O6 H2O HCl NH4OH |
3. Ujilah daya hantar listrik masing-masing larutan tersebut dengan cara mencelupkan kedua elektrode karbon ke dalam larutan uji secara bergantian!
Perhatian ! : Setiap akan mengganti larutan yang diukur daya hantar listriknya, elektrode karbon harus terlebih dahulu dicuci hingga higienis biar data eksperimen tidak bias (valid).
4. Amati perubahan yang terjadi pada lampu dan batang elektrode. Catatlah hasil pengamatan pada tabel pengamatan!
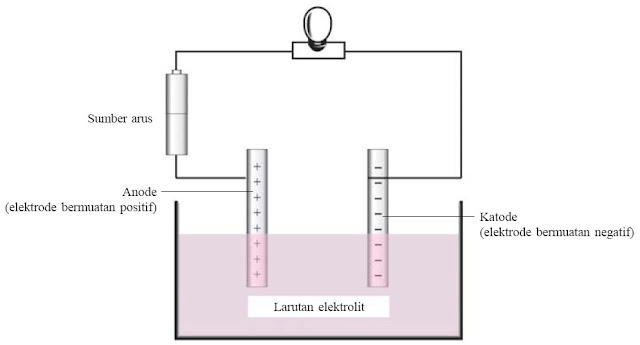 |
| Gambar 2. Susunan alat uji daya hantar listrik |
Pertanyaan:
1. Dari hasil eksperimen, sebutkan larutan yang bersifat elektrolit dan nonelektrolit!
2. Kelompokkan larutan uji menurut nyala lampu dan pengamatan elektrode dalam kategori: kelompok menyala terang dan timbul gelembung gas, menyala redup dan timbul gelembung gas, tidak menyala tetapi timbul gelembung gas, serta tidak menyala dan tidak timbul gelemgung gas. Kesimpulan apa yang sanggup Anda ambil?
3. Berdasarkan rumus kimia larutan uji di atas, larutan manakah yang termasuk golongan:
a. senyawa ion
b. senyawa kovalen
4. Buatlah kekerabatan hubungan antara tanggapan pertanyaan nomor 2 dengan tanggapan pertanyaan nomor 3, kemudian simpulkan dan carilah di literatur-literatur kimia, mengapa bisa menyerupai itu?
Anda kini sudah mengetahui Perbedaan Larutan Elektrolit dan Nonelektrolit. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Setyawati, A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 186.
[2] Permana, I. 2009. Memahami Kimia 1 : SMA/MA untuk Kelas Semester 1 dan 2. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 175.
[3] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.





