Contoh, Sifat, dan Pembentukan Ikatan Ion, Contoh Soal, Senyawa dan Unsur Kimia, Kunci Jawaban - Anda tentu tidak abnormal lagi dengan garam dapur. Hampir setiap kuliner yang Anda makan niscaya mengandung garam dapur. Senyawa kimia yang mempunyai rumus kimia NaCl ini berwujud padat, namun gampang rapuh. Garam dapur juga mempunyai titik didih yang sangat tinggi. Tahukah Anda, mengapa garam dapur mempunyai sifat ibarat itu? Sifat dari suatu senyawa kimia termasuk garam dapur dipengaruhi oleh jenis ikatan kimia dan struktur senyawa tersebut.
Bagaimanakah cara unsur penyusun garam dapur berikatan? Bagaimana struktur senyawa garam dapur? Selidikilah oleh Anda dengan melaksanakan acara berikut.
Percobaan Kimia Sederhana :
Proses Pembentukan Ikatan Ion
Tujuan :
Menyelidiki proses terjadinya ikatan ion
Alat dan Bahan :
Tabel periodik unsur-unsur kimia
Langkah Kerja :
- Tuliskanlah konfigurasi elektron unsur-unsur yang menyusun garam dapur.
- Gambarkanlah struktur elektronnya.
Jawablah pertanyaan berikut untuk menyimpulkan fakta.
- Berapakah jumlah elektron dan proton atom Na?
- Berapakah jumlah elektron dan proton atom Cl?
- Apakah yang akan terjadi bila atom Na melepaskan elektron?
- Apakah yang akan terjadi bila atom Cl mendapatkan elektron?
- Bagaimana cara atom Na dan Cl berikatan?
- Bagaimana struktur senyawa NaCl?
Diskusikanlah hasil yang Anda peroleh dengan sobat Anda.
Bagaimana hasil penyelidikan Anda mengenai proses pembentukan ikatan ion? Untuk lebih memahaminya, pelajarilah klarifikasi berikut.
1. Pengertian Ikatan Ion
Ikatan ion yakni ikatan yang terbentuk sebagai akhir adanya gaya tarik-menarik antara ion kasatmata dan ion negatif. Ion kasatmata terbentuk lantaran unsur logam melepaskan elektronnya, sedangkan ion negatif terbentuk lantaran unsur nonlogam mendapatkan elektron. Ikatan ion terjadi lantaran adanya serah terima elektron. [1]
Atom-atom membentuk ikatan ion lantaran masing-masing atom ingin mencapai keseimbangan/kestabilan ibarat struktur elektron gas mulia. Ikatan ion terbentuk antara:
a. ion kasatmata dengan ion negatif,
b. atom-atom berenergi potensial ionisasi kecil dengan atom-atom berafinitas elektron besar (Atom-atom unsur golongan IA, IIA dengan atom-atom unsur golongan VIA, VIIA),
c. atom-atom dengan keelektronegatifan kecil dengan atom-atom yang mempunyai keelektronegatifan besar. [1]
Sifat-sifat senyawa ion sebagai berikut.
a. Dalam bentuk padatan tidak menghantar listrik lantaran partikel-partikel ionnya terikat berpengaruh pada kisi, sehingga tidak ada elektron yang bebas bergerak.
b. Leburan dan larutannya menghantarkan listrik.
c. Umumnya berupa zat padat kristal yang permukaannya keras dan sukar digores.
d. Titik leleh dan titik didihnya tinggi.
e. Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar. [1]
1. Pengertian Ikatan Ion
Ikatan ion yakni ikatan yang terbentuk sebagai akhir adanya gaya tarik-menarik antara ion kasatmata dan ion negatif. Ion kasatmata terbentuk lantaran unsur logam melepaskan elektronnya, sedangkan ion negatif terbentuk lantaran unsur nonlogam mendapatkan elektron. Ikatan ion terjadi lantaran adanya serah terima elektron. [1]
Atom-atom membentuk ikatan ion lantaran masing-masing atom ingin mencapai keseimbangan/kestabilan ibarat struktur elektron gas mulia. Ikatan ion terbentuk antara:
a. ion kasatmata dengan ion negatif,
b. atom-atom berenergi potensial ionisasi kecil dengan atom-atom berafinitas elektron besar (Atom-atom unsur golongan IA, IIA dengan atom-atom unsur golongan VIA, VIIA),
c. atom-atom dengan keelektronegatifan kecil dengan atom-atom yang mempunyai keelektronegatifan besar. [1]
Sifat-sifat senyawa ion sebagai berikut.
a. Dalam bentuk padatan tidak menghantar listrik lantaran partikel-partikel ionnya terikat berpengaruh pada kisi, sehingga tidak ada elektron yang bebas bergerak.
b. Leburan dan larutannya menghantarkan listrik.
c. Umumnya berupa zat padat kristal yang permukaannya keras dan sukar digores.
d. Titik leleh dan titik didihnya tinggi.
e. Larut dalam pelarut polar dan tidak larut dalam pelarut nonpolar. [1]
2. Atom Na dan Cl Berikatan dengan Cara Serah Terima Elektron
Atom Na mempunyai konfigurasi elektron 2 8 1 sehingga elektron valensinya 1. Adapun konfigurasi elektron atom Cl yakni 2 8 7 sehingga elektron valensinya yakni 7. Dalam keadaan netral, atom Na dan Cl mempunyai jumlah elektron dan proton yang sama banyak. Atom Na mempunyai 11 proton dan 11 elektron, sedangkan atom Cl mempunyai 17 proton dan 17 elektron.
Pada keadaan ini, atom Na dan Cl tidak stabil. Berdasarkan kaidah oktet, untuk mencapai kestabilannya, atom Na harus melepaskan 1 elektron, sedangkan atom Cl membutuhkan 1 elektron. Apakah yang terjadi bila atom Na melepaskan elektron dan atom Cl mendapatkan 1 elektron?
Atom Na akan bermuatan kasatmata lantaran jumlah proton lebih banyak daripada jumlah elektron. Adapun atom Cl akan bermuatan negatif lantaran jumlah proton lebih sedikit daripada jumlah elektron. Dengan demikian, atom Na dan Cl sanggup mencapai kestabilannya dengan cara serah terima elektron. Atom Na menyerahkan 1 elektron kepada atom Cl sehingga atom Cl mendapatkan 1 elektron dari atom Na.
Karena berbeda muatan, ion Na+ dan ion Cl– akan saling tarik-menarik. Interaksi yang dinamakan interaksi elektrostatik ini berlangsung secara terusmenerus. Ikatan kimia yang terbentuk dengan cara serah terima elektron, ibarat pembentukan NaCl, dinamakan ikatan ion. Senyawa yang terbentuk melalui ikatan ion disebut senyawa ion.
Catatan Kimia :
Ikatan ion yakni ikatan elektrostatik antara kation dan anion yang menyatukan ion-ion menjadi senyawa ionik. Contohnya ikatan pada senyawa NaCl.
Menurut Anda, adakah senyawa lain selain NaCl yang proses pembentukan senyawanya melalui ikatan ion? Pelajarilah teladan soal berikut.
Contoh Soal 1 :
Bagaimana proses pembentukan ikatan ion pada senyawa-senyawa berikut.
a. CaCl2
b. MgO
Kunci Jawaban :
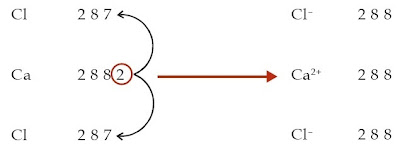
a. Konfigurasi elektron atom Ca: 2 8 8 2
Konfigurasi elektron atom Cl: 2 8 7
Untuk mencapai kestabilannya, atom Ca harus melepaskan 2 elektron, sedangkan atom Cl membutuhkan 1 elektron. Jadi, atom Ca menawarkan masing-masing 1 elektron kepada 2 atom Cl sehingga 1 atom Ca mengikat 2 atom Cl. Setelah melepaskan 2 elektron, atom Ca menjadi ion Ca2+. Adapun atom Cl menjadi ion Cl– setelah mendapatkan 1 elektron. Senyawa yang terbentuk adalah CaCl2.
b. Konfigurasi atom Mg: 2 8 2
Konfigurasi atom O: 2 6
Untuk mencapai kestabilannya, atom Mg harus melepaskan 2 elektron, sedangkan atom O membutuhkan 2 elektron. Jadi, atom Mg menawarkan 2 elektron kepada atom O sehingga 1 atom Mg mengikat 1 atom O. Setelah melepaskan 1 elektron, atom Mg menjadi ion Mg2+ . Adapun atom O menjadi ion O2–, senyawa yang terbentuk yakni MgO.
Contoh Soal 2 :
Unsur Mg, C, N, O dan S berturut-turut mempunyai nomor atom: 12, 6, 7, 8, dan 16. Pasangan unsur yang mempunyai ikatan ionik yakni ....
A. C dan S
B. Mg dan O
C. N dan O
D. C dan O
E. C dan N
Kunci Jawaban :
Ikatan ionik yakni ikatan antara unsur logam dan non logam. Ikatan ion terjadi antara unsur yang melepas elektron dan unsur yang mendapatkan elektron. Unsur logam: Mg Unsur non logam: C, N, O, S Jadi, yang mungkin terjadi ikatan ion yakni (B) Mg dan O.
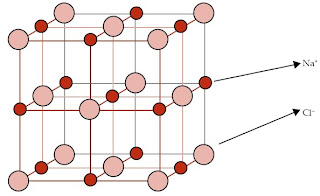
3. Senyawa Ion Memiliki Struktur Ion Raksasa (Lattice)
Garam dapur (NaCl) merupakan senyawa ionik yang penting dalam kehidupan sehari-hari. Petani garam memperoleh kristal NaCl secara tradisional yaitu dengan cara menguapkan air maritim dengan pertolongan sinar matahari.
Jutaan atau bahkan miliaran ion Na+ dan ion Cl- dalam garam saling tarik-menarik sehingga membentuk struktur ion raksasa. Bagian kecil dari struktur ion raksasa NaCl sanggup diamati pada gambar berikut.
Jika Anda mengamati gambar tersebut secara teliti, Anda akan melihat bahwa setiap ion Na+ sanggup mengikat 6 ion Cl-. Begitu pula dengan ion Cl- yang sanggup mengikat 6 ion Na+.
Contoh Soal 3 :
Nomor atom unsur A, B, C, D, dan E berturut-turut 6, 8, 9, 16, dan 19. Pasangan unsur yang sanggup membentuk ikatan ion yakni pasangan antara unsur ….
A. A dan C
B. C dan E
C. B dan D
D. C dan D
E. A dan B
Kunci Jawaban :
Ikatan ion terbentuk antara atom logam dan nonlogam. Sifat atom logam dan nonlogam ditentukan oleh elektron valensi.
Atom | Nomor Atom | Konfigurasi Elektron | Elektron Valensi | Sifat Atom |
A | 6 | 2 4 | 4 | Nonlogam |
B | 8 | 2 6 | 6 | Nonlogam |
C | 9 | 2 7 | 7 | Nonlogam |
D | 16 | 2 8 6 | 6 | Nonlogam |
E | 19 | 2 8 8 1 | 1 | Logam |
Jadi, pasangan yang sanggup membentuk ikatan ion yakni (B) C dan E.
3. NaCl Memiliki Titik Didih yang Sangat Tinggi dan Mudah Rapuh
Na+ dan Cl- memiliki interaksi elektrostatik yang sangat berpengaruh sehingga untuk memutuskan ikatan tersebut dibutuhkan energi yang cukup tinggi. Itulah sebabnya senyawa NaCl mempunyai titik didih yang sangat tinggi, yaitu 1.465 °C.
Selain titik didih yang sangat tinggi, NaCl juga mempunyai sifat gampang rapuh. Mengapa demikian? Struktur NaCl tersusun atas beberapa lapisan. Bayangkanlah apa yang akan terjadi bila lapisan cuilan atas kristal NaCl diberikan dorongan.
Lapisan cuilan atas akan bergeser sehingga ion-ion pada lapisan atas dan lapisan di bawahnya yang bermuatan sama akan saling berhadapan. Anda tentu telah mengetahui bahwa ion-ion yang bermuatan sama akan tolak-menolak. Dengan demikian, ikatan akan terlepas sehingga tidak heran bila garam dapur gampang rapuh. Ujilah kerapuhan garam dapur yang masih berbentuk balok.
4. Contoh Ikatan Ion Lainnya :
a . Ikatan ion pada 19K dan 8O dalam K2O [1]
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2K+ + O2– → K2O
b. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3 [1]
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3Cl– → FeCl3
c. Ikatan ion antara Ca dan F [2]
Konfigurasi elektron:
Ca : 2, 7 (melepas 2 elektron) membentuk Ca2+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 2 sehingga menjadi 2F, masing-masing mendapatkan 1 elektron dari Ca)
Sehingga persamaan reaksinya menjadi :
Ca2+ + 2F– → CaF2
4. Contoh Ikatan Ion Lainnya :
a . Ikatan ion pada 19K dan 8O dalam K2O [1]
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk K+
O : 2, 6 (menerima 2 elektron) membentuk O2–
2K+ + O2– → K2O
b. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk FeCl3 [1]
Fe mempunyai elektron valensi 3 akan membentuk Fe3+
Cl mempunyai elektron valensi 7 akan membentuk Cl–
Fe3+ + 3Cl– → FeCl3
c. Ikatan ion antara Ca dan F [2]
Konfigurasi elektron:
Ca : 2, 7 (melepas 2 elektron) membentuk Ca2+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 2 sehingga menjadi 2F, masing-masing mendapatkan 1 elektron dari Ca)
Sehingga persamaan reaksinya menjadi :
Ca2+ + 2F– → CaF2
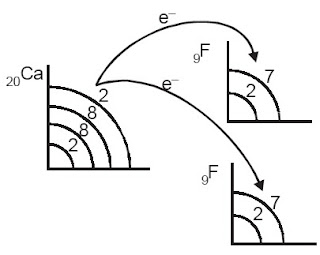 |
| Perpindahan elektron dari Ca ke F. |
Konfigurasi elektron:
Li : 2, 1 (melepas 1 elektron) membentuk Li+ (2)
O : 2, 6 (menerima 2 elektron) membentuk O + 2e- (2, 8)
Sehingga persamaan reaksinya menjadi :
2Li+ + O2– → Li2O
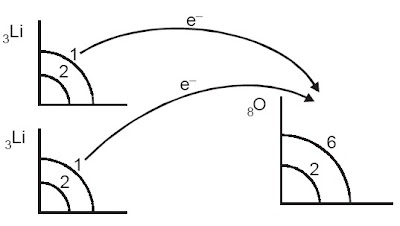 |
| Perpindahan elektron dari Li ke O. |
Konfigurasi elektron:
Al : 2, 8, 3 (melepas 3 elektron) membentuk Al3+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F + 1e- (2, 8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 3 sehingga menjadi 3F, masing-masing mendapatkan 1 elektron dari Al)
Sehingga persamaan reaksinya menjadi :
Al3+ + 3F– → AlF3
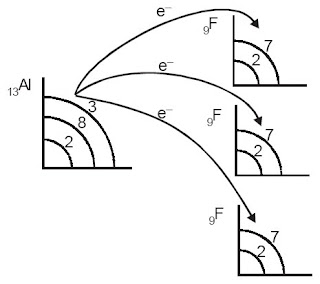 |
| Perpindahan elektron dari Al ke F. |
Linus Carl Pauling (1901–1994)
 |
| Linus Carl Pauling. [3] |
Linus Carl Pauling (1901– 1994) yakni kimiawan populer kurun ke-20. Dia juga merupakan satu-satunya akseptor dua hadiah Nobel untuk dua kategori yang berbeda, yaitu Nobel Kimia pada 1954 dan Nobel Perdamaian pada 1962. Sejak kecil Pauling sudah gemar membaca banyak sekali buku. Pauling juga mengunjungi laboratorium kimia milik Lloyd Jeffress. Pada dikala Sekolah Menengan Atas ia melanjutkan bereksperimen di bidang kimia memakai materi dan perlengkapan yang ia pinjam dari pabrik baja di kawasan ia bekerja. Karyanya di bidang kimia yang sangat dikagumi yakni hasil penelitiannya ihwal sifat-sifat ikatan kimia yang tertuang dalam bukunya yang populer The Nature of the Chemical Bond and the Structure of Molecules and Crystals: An Introduction to Modern Structural Chemistry. (Sumber: Chem-is-try.org)
Anda kini sudah mengetahui Ikatan Ion. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Setyawati, A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 186.
[2] Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.
[3] http://en.wikipedia.org/wiki/Linus_Pauling
[2] Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.
[3] http://en.wikipedia.org/wiki/Linus_Pauling