Konsep Redoks Berdasarkan Kenaikan dan Penurunan Bilangan Oksidasi - Sebelum mempelajari konsep reaksi redoks menurut kenaikan dan penurunan bilangan oksidasi ada baiknya kau berguru perihal bilangan oksidasi terlebih dahulu. Bilangan oksidasi (bilok) ialah jumlah muatan yang dimiliki atom suatu unsur kalau bergabung dengan atom unsur lain. Aturan bilok:
a. Unsur bebas memiliki bilok 0 (nol). Yang termasuk unsur bebas: unsur diatomik (H2, N2, O2, F2, Cl2, Br2, I2), unsur poliatomik (O3, P4, S8). Selain unsur tersebut ialah unsur monoatomik (Na, K, Mg, C, dan lain-lain).
Contoh :
H dalam H2
O dalam O2 dan O3
F dalam F2
Na dalam Na
b. Unsur H umumnya memiliki bilok (+1), kecuali pada senyawa hidrida memiliki bilok (–1). Senyawa hidrida ialah senyawa yang terbentuk kalau logam bergabung dengan atom H (Contoh: NaH, KH, CaH2). Contoh: H dalam H2O, NH3, HCl.
c. Unsur O umumnya memiliki bilok (–2), kecuali :
- Pada senyawa peroksida misalnya : Na2O2, H2O2, BaO2 mempunyai bilok (–1).
- Senyawa F2O mempunyai bilok (+2), dan
- Senyawa superoksida (contohnya KO2) memiliki bilok (-1/2).
Contoh: O dalam H2O, Na2O, Fe2O3, MgO.
d. Unsur logam dalam senyawa umumnya memiliki bilok positif.
Contoh :
- Golongan IA (Li, Na, K, Rb, dan Cs) memiliki bilok (+1).
- Golongan IIA ( Be, Mg, Ca, Sr, dan Ba) memiliki bilok (+2).
- Al3+, Ag+, Zn2+, Pb2+, Pb3+, Fe2+, dan Fe3+.
e. Unsur non logam umumnya memiliki bilok negatif.
Contoh :
- Golongan VIIA (F, Cl, Br, I) memiliki bilok (–1).
- Golongan VIA (O, S, Se, Te) memiliki bilok (–2).
f. Jumlah bilok unsur-unsur dalam ion sama dengan jumlah muatannya.
Contoh:
Bilok S dalam SO42–
Bilok O = –2
Jumlah bilok = (1 x bilok S + 4 x bilok O)
–2 = (1 x bilok S + 4 x (–2))
–2 = bilok S + (–8)
Bilok S = +6
g. Jumlah bilok unsur-unsur dalam senyawa sama dengan 0 (nol).
Contoh : H2S
Jumlah bilok = ((2 x bilok H) + (1 x bilok S))
0 = ((2 x (+1)) + (1 x bilok S))
0 = (+2) + bilok S
Bilok S = (–2)
Setelah menguasai bilok kita coba terapkan dalam reaksi redoks. Reaksi oksidasi ialah reaksi kenaikkan bilok. Sedangkan reaksi reduksi ialah reaksi penurunan bilok.
Contoh :
1. Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
Bilok Zn (unsur bebas) = 0
Bilok Zn dalam ZnCl2 = +2
Berarti Zn mengalami kenaikkan bilok, maka Zn mengalami reaksi oksidasi.
Bilok H dalam HCl = +1
Bilok H dalam H2 (unsur bebas) = 0
Jadi, H mengalami penurunan bilok, maka H mengalami reaksi reduksi.
2. Reaksi pemakaian baterai: Zn + 2 NH4Cl → ZnCl2 + 2 NH3 + H2
Bilok Zn (unsur bebas) = 0
Bilok Zn pada ZnCl2 = +2
Berarti Zn mengalami kenaikkan bilok, maka Zn mengalami reaksi oksidasi.
Bilok H pada NH4Cl = +1
Bilok H pada H2 (unsur bebas = 0)
Berarti H mengalami penurunan bilok, maka H mengalami reaksi reduksi.
3. Reaksi pengolahan bijih besi
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Bilok Fe pada Fe2O3 = +3
Bilok Fe (unsur bebas) = 0
Berarti Fe mengalami penurunan bilok, maka Fe mengalami reaksi reduksi.
Bilok C pada CO = +2
Bilok C pada CO2 = +4
Berarti C mengalami kenaikkan bilok, maka C mengalami reaksi oksidasi.
4. Reaksi penyepuhan/pelapisan logam.
Cu + 2 AgNO3 → Cu(NO3)2 + 2 Ag
Bilok Cu (unsur bebas) = 0
Bilok Cu pada Cu(NO3)2 = +2
Berarti Cu mengalami kenaikkan bilok, maka Cu mengalami reaksi oksidasi.
Bilok Ag pada AgNO3 = +1
Bilok Ag (unsur bebas) = 0
Berarti Ag mengalami penurunan bilok, maka Ag mengalami reaksi reduksi.
Pada reaksi di atas terjadi kenaikkan bilok (reaksi oksidasi) dan penurunan bilok (reaksi reduksi) secara bersama-sama, maka disebut reaksi redoks. Jika suatu zat mengalami reaksi oksidasi sekaligus reduksi, maka reaksi ini disebut autoredoks (disproporsionasi).
Contoh :
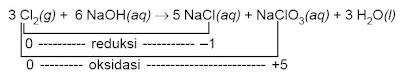
6 NaOH(aq) + 3 Cl2(g) → 5 NaCl(aq) + NaClO3(aq) + 3 H2O(l)
Bilok Cl dalam Cl2 (unsur bebas) = 0
Bilok Cl dalam NaCl = 1
Bilok Cl dalam NaClO3 = +5
Jadi, Cl mengalami kenaikkan bilok (reaksi oksidasi) dan penurunan bilok (reaksi reduksi) sekaligus.
Contoh lain : [1]
a. Reduksi ialah reaksi penurunan bilangan oksidasi.
Reduktor adalah:
- Zat yang mereduksi zat lain dalam reaksi redoks.
- Zat yang mengalami oksidasi.
Contoh :
2 SO3 → 2 SO2 + O2
Bilangan oksidasi S dalam SO3 adalah +6 sedangkan pada SO2 adalah +4. Karena unsur S mengalami penurunan bilangan oksidasi, yaitu dari +6 menjadi +4, maka SO3 mengalami reaksi reduksi. Oksidatornya adalah SO3 dan zat hasil reduksi adalah SO2.
b. Oksidasi ialah reaksi pertambahan bilangan oksidasi.
Oksidator adalah:
- Zat yang mengoksidasi zat lain dalam reaksi redoks.
- Zat yang mengalami reaksi reduksi.
Contoh :
4 FeO + O2 → 2 Fe2O3
Bilangan oksidasi Fe dalam FeO ialah +2, sedangkan dalam Fe2O3 adalah +3. Karena unsur Fe mengalami kenaikan bilangan oksidasi, yaitu dari +2 menjadi +3, maka FeO mengalami reaksi oksidasi. Reduktornya ialah FeO dan zat hasil oksidasi adalah Fe2O3. (James E. Brady, 1999)
Jika suatu reaksi kimia mengalami reaksi reduksi dan oksidasi sekaligus dalam satu reaksi, maka reaksi tersebut disebut reaksi reduksi-oksidasi atau reaksi redoks. Contoh:
a. 4 FeO + O2 → 2 Fe2O3 (bukan reaksi redoks)
b. Fe2O3 + 3 CO → 2 Fe + 3 CO2 (reaksi redoks)
Anda kini sudah mengetahui Konsep Redoks Berdasarkan Kenaikan dan Penurunan Bilangan Oksidasi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.
Referensi Lainnya :
[1] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.