Perkembangan Konsep Reaksi Redoks (Reduksi dan Oksidasi) - Pengetahuan insan mengenai reaksi redoks senantiasa berkembang. Perkembangan konsep reaksi redoks menghasilkan dua konsep, klasik dan modern. Awalnya, reaksi redoks dipandang sebagai hasil dari perpindahan atom oksigen dan hidrogen. Oksidasi merupakan proses terjadinya penangkapan oksigen oleh suatu zat. Sementara itu reduksi ialah proses terjadinya pelepasan oksigen oleh suatu zat. Oksidasi juga diartikan sebagai suatu proses terjadinya pelepasan hidrogen oleh suatu zat dan reduksi ialah suatu proses terjadinya penangkap hidrogen. Oleh alasannya ialah itu, teori klasik menyampaikan bahwa oksidasi ialah proses penangkapan oksigen dan kehilangan hidrogen. Di sisi lain, reduksi ialah proses kehilangan oksigen dan penangkapan hidrogen. [1]
 |
| Reaksi redoks. [2] |
Seiring dilakukannya banyak sekali percobaan, konsep redoks juga mengalami perkembangan. Muncullah teori yang lebih modern yang sampai ketika ini masih dipakai. Dalam teori ini disebutkan bahwa:
a. Oksidasi ialah proses yang menjadikan hilangnya satu atau lebih elektron dari dalam zat. Zat yang mengalami oksidasi menjadi lebih positif.
b. Reduksi ialah proses yang menjadikan diperolehnya satu atau lebih elektron oleh suatu zat. Zat yang mengalami reduksi akan menjadi lebih negatif.
Teori ini masih digunakan sampai ketika ini. Makara proses oksidasi dan reduksi tidak hanya dilihat dari penangkapan oksigen dan hidrogen, melainkan dipandang sebagai proses perpindahan elektron dari zat yang satu ke zat yang lain. [1]
Jika Anda membelah buah apel, lalu membiarkannya di ruang terbuka, buah apel tersebut akan berubah warna menjadi kecokelat-cokelatan. Tahukah Anda, mengapa hal tersebut sanggup terjadi? Perubahan warna pada buah apel diakibatkan reaksi oksidasi yang dialami senyawa kimia yang terkandung dalam buah apel.
Suatu reaksi oksidasi biasanya disertai oleh reaksi reduksi sehingga lazim disebut reaksi redoks. Apakah reaksi reduksi oksidasi itu? Konsep reaksi redoks sanggup ditinjau dari tiga konsep, yaitu penggabungan dan pelepasan oksigen, pelepasan dan penerimaan elektron, serta peningkatan dan penurunan bilangan oksidasi. Agar Anda memahami perbedaan ketiga konsep reaksi redoks tersebut, lakukanlah penyelidikan berikut.
Praktikum / Percobaan Kimia Sederhana 1 :
Reaksi Reduksi Oksidasi
Tujuan :
Menyelidiki perbedaan konsep-konsep reaksi redoks
Alat dan Bahan :
Reaksi-reaksi redoks
Langkah Kerja :
1. Pelajarilah contoh-contoh reaksi redoks dalam tabel berikut.
Peristiwa | Persamaan Reaksi Kimia |
Pengaratan logam | 4 Fe(s) + 3 O2(g) → 2 Fe2O3(s) |
Isolasi logam besi | 2 Fe2O3(s) + 3 C(s) → 2 Fe(s) + 3 CO2(g) |
Reaksi logam Mg dan gas klorin | Mg(s) + Cl2(g) → MgCl2(s) |
2. Bandingkanlah posisi logam Fe dan senyawa Fe2O3 pada reaksi pengaratan logam besi dan isolasi logam besi.
3. Gambarkanlah pembentukan ikatan pada MgCl2.
4. Dengan memanfaatkan tabel periodik, tentukanlah bilangan oksidasi atom Mg pada logam Mg dan MgCl2 erta bilangan oksidasi atom Cl pada Cl2 dan MgCl2.
Jawablah pertanyaan berikut untuk menyimpulkan fakta.
- Pada reaksi manakah logam Fe mengikat oksigen?
- Pada reaksi manakah Fe2O3 melepaskan oksigen?
- Pada reaksi antara logam Mg dan gas klorin, atom manakah yang menyerahkan elektron?
- Pada reaksi antara logam Mg dan gas klorin, atom manakah yang mendapatkan elektron?
- Pada reaksi antara logam Mg dan gas klorin, bilangan oksidasi atom manakah yang mengalami peningkatan?
- Pada reaksi antara logam Mg dan gas klorin, bilangan oksidasi atom manakah yang mengalami penurunan?
- Kerjakanlah secara berkelompok dan diskusikan hasil yang diperoleh.
Bagaimana membedakan konsep-konsep redoks? Pelajarilah klarifikasi berikut.
1. Konsep Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen
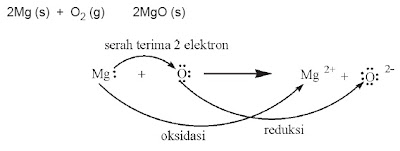
2. Konsep Redoks Berdasarkan Penyerahan dan Penerimaan Elektron
Anda kini sudah mengetahui Konsep Reaksi Redoks. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Setyawati, A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 186.
[2] Permana, I. 2009. Memahami Kimia 1 : SMA/MA untuk Kelas Semester 1 dan 2. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 175.
[2] Permana, I. 2009. Memahami Kimia 1 : SMA/MA untuk Kelas Semester 1 dan 2. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 175.





