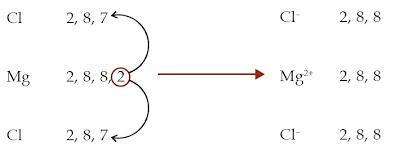
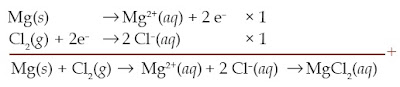Konsep Redoks Berdasarkan Pengikatan dan Pelepasan / Penerimaan Elektron - Atom Mg mempunyai konfigurasi elektron 2 8 2 sehingga elektron valensinya 2. Adapun konfigurasi elektron atom Cl yakni 2 8 7 sehingga elektron valensinya yakni 7. Untuk mencapai kestabilannya, atom Mg harus melepaskan 2 elektron, sedangkan atom Cl membutuhkan 1 elektron. Jadi, atom Mg menawarkan masing-masing 1 elektron kepada 2 atom Cl sehingga 1 atom Mg mengikat 2 atom Cl. Setelah melepaskan 2 elektron, atom Mg menjadi ion Mg2+. Adapun atom Cl menjadi ion Cl– setelah mendapatkan 1 elektron. Senyawa yang terbentuk yakni MgCl2.
Reaksi kimia yang terjadi pada pembentukan ikatan MgCl2 dapat juga dituliskan melalui tahapan berikut.
Mg(s) → Mg2+(aq) + 2 e– merupakan reaksi oksidasi, sedangkan Cl2(aq) + 2 e–→2 Cl–(aq) merupakan reaksi reduksi. Berdasarkan pada pola ini, reaksi oksidasi yakni reaksi pelepasan elektron, sedangkan reaksi reduksi yakni reaksi penerimaan elektron. Zat yang mengalami reaksi oksidasi disebut reduktor, sedangkan zat yang mengalami reaksi reduksi disebut oksidator. Jadi, Mg merupakan reduktor dan Cl2 merupakan oksidator.
Contoh Lain : [1]
a. Reduksi yakni reaksi pengikatan elektron.
Reduktor yakni :
- Zat yang melepaskan elektron.
- Zat yang mengalami oksidasi.
Contoh :
- Na(s) → Na+(aq) + e– [2]
b. Oksidasi yakni reaksi pelepasan elektron.
Oksidator yakni :
- Zat yang mengikat elektron.
- Zat yang mengalami reduksi.
Contoh:
- K → K+ + e–
- Cu → Cu2+ + 2 e–
- S(s) + 2 e– → S2–(aq)
2 Na(s) + S(s) → Na2S(s)
Ingin lebih memahami konsep reaksi redoks menurut penerimaan dan pelepasan elektron? Pelajarilah pola soal berikut.
Contoh Soal 1 :
Tentukanlah reaksi oksidasi, reaksi reduksi, oksidator, dan reduktor pada reaksi-reaksi berikut.
a. 2 Na(s) + Cl2(s) → 2 NaCl(s)
b. 2 Ca(s) + O2(g) → 2 CaO(s)
Kunci Jawaban :
a. Reaksi oksidasi : 2 Na(s) → 2 Na+(aq) + 2 e–
Reaksi reduksi : Cl2(g) + 2 e– → 2 Cl–(aq)
Reduktor : Na
Oksidator : Cl2
b. Reaksi oksidasi : 2 Ca(s) → 2 Ca2+(aq) + 4 e–
Reaksi reduksi : O2(g) + 4 e– → 2 O2–(g)
Reduktor : Ca
Oksidator : O2
Anda kini sudah mengetahui Konsep Redoks Berdasarkan Pengikatan dan Pelepasan Elektron. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.
[2] Harnanto, A. dan Ruminten. 2009. Kimia 1 : untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 194.