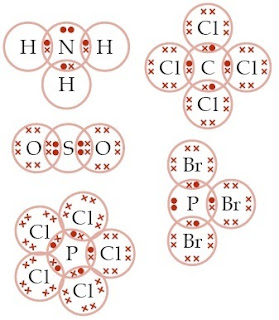
Aturan / Kaidah Oktet dan Duplet, Ikatan Kovalen, Contoh, Pengertian, Soal, Kunci Jawaban, Unsur Kimia - Unsur-unsur dari golongan gas mulia sanggup bersifat duplet, contohnya helium, dan oktet, contohnya neon, argon, xenon, kripton, dan radon. Duplet yaitu apabila atom mempunyai 2 elektron di kulit terluarnya atau atom pusatnya dikelilingi 2 elektron (1 pasangan elektron). sedangkan oktet yaitu apabila atom mempunyai 8 atom di kulit terluarnya atau atom pusatnya dikelilingi 8 elektron (4 pasangan elektron). (Baca : Tabel Konfigurasi Elektron Unsur Gas mulia).
Ikatan kovalen terbentuk antara atom nonlogam dan atom nonlogam lainnya dengan cara pemakaian elektron bersama sehingga setiap atom yang terlibat memenuhi kaidah oktet/duplet. Menurut Anda, apakah semua senyawa yang tersusun atas atom-atom nonlogam memenuhi kaidah oktet dalam pembentukannya? Perhatikanlah reaksi antara atom P dan Cl. Reaksi antara fosfor dan klorin akan menghasilkan PCl3 dan PCl5. Jumlah PCl3 dan PCl5 yang terbentuk bergantung pada banyaknya klorin yang direaksikan. Pada senyawa PCl3, 1 atom P mengikat 3 atom Cl. Adapun pada PCl5, 1 atom P mengikat 5 atom Cl. Perhatikanlah gambar berikut. (Baca juga : Sifat Ikatan Kovalen)
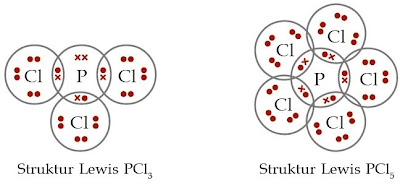 |
| Gambar 1. Struktur Lewis PCl3 dan PCl5. |
Struktur Lewis PCl3 menunjukkan bahwa setiap atom yang terlibat (1 atom P dan 3 atom Cl) telah memenuhi kaidah oktet. Lain halnya dengan PCl5, struktur Lewisnya mengatakan hanya atom Cl yang memenuhi kaidah oktet, sedangkan atom P tidak memenuhi kaidah oktet. Atom P mempunyai 10 elektron pada kulit terluarnya.
Senyawa lain yang tidak memenuhi kaidah oktet yaitu BF3.
 |
| Gambar 2. Struktur Lewis BF3. |
Atom B hanya mempunyai 3 elektron valensi sehingga memerlukan 5 elektron untuk memenuhi kaidah oktet. Adapun atom F mempunyai 1 elektron valensi sehingga hanya membutuhkan 1 elektron. Setiap atom F mendapatkan 1 elektron yang disumbangkan atom B. Namun, atom B hanya mendapatkan 1 elektron dari setiap atom F. Berarti, atom B kekurangan 2 elektron untuk memenuhi kaidah oktet.
Contoh Soal :
N=7, O=8, P=15, S=16, Cl=17, dan Br = 35.
Senyawa berikut mengikuti hukum oktet, kecuali ….
A. NH3
B. CCl4
C. SO2
D. PBr3
E. PCl5
Kunci Jawaban :
Suatu senyawa mengikuti hukum oktet (kaidah oktet) jikalau atom pusatnya dikelilingi 8 elektron (4 pasangan elektron).
Senyawa | Atom Pusat | Jumlah Elektron yang Mengelilingi |
NH3 | N | 8 |
CCl4 | C | 8 |
SO2 | S | 8 |
PBr3 | P | 8 |
PCl5 | P | 10 |
Jadi, senyawa yang tidak mengikuti kaidah oktet adalah (E) PCl5.
Pengecualian dan Kegagalan Aturan Oktet
Walaupun hukum oktet banyak membantu dalam meramalkan rumus kimia senyawa biner sederhana, akan tetapi hukum itu ternyata banyak dilanggar dan gagal dalam meramalkan rumus kimia senyawa dari unsur-unsur transisi dan postransisi.
A. Pengecualian Aturan Oktet
Pengecualian hukum oktet sanggup dibagi dalam tiga kelompok sebagai berikut.
1. Senyawa yang tidak mencapai hukum oktet.
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini mengakibatkan sesudah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl2, BCl3, dan AlBr3.
2. Senyawa dengan jumlah elektron valensi ganjil.
Contohnya adalah NO2, yang mempunyai elektron valensi (5 + 6 + 6) = 17. Kemungkinan rumus Lewis untuk NO2 sebagai berikut.
3. Senyawa yang melampaui hukum oktet.
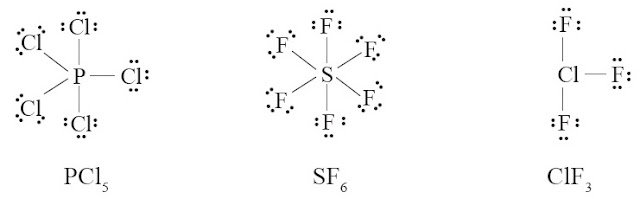
Ini terjadi pada unsur-unsur periode 3 atau lebih yang sanggup menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M sanggup menampung sampai 18 elektron). Beberapa pola adalah PCl5, SF6, ClF3, IF7, dan SbCl5.
Perhatikan rumus Lewis dari PCl5, SF6, dan ClF3 berikut ini.
B. Kegagalan Aturan Oktet
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur postransisi yaitu unsur logam sesudah unsur transisi, contohnya Ga, Sn, dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +2. Begitu juga Bi yang mempunyai 5 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3. Pada umumnya, unsur transisi maupun unsur postransisi tidak memenuhi hukum oktet.
Referensi :
Walaupun hukum oktet banyak membantu dalam meramalkan rumus kimia senyawa biner sederhana, akan tetapi hukum itu ternyata banyak dilanggar dan gagal dalam meramalkan rumus kimia senyawa dari unsur-unsur transisi dan postransisi.
A. Pengecualian Aturan Oktet
Pengecualian hukum oktet sanggup dibagi dalam tiga kelompok sebagai berikut.
1. Senyawa yang tidak mencapai hukum oktet.
Senyawa yang atom pusatnya mempunyai elektron valensi kurang dari 4 termasuk dalam kelompok ini. Hal ini mengakibatkan sesudah semua elektron valensinya dipasangkan tetap belum mencapai oktet. Contohnya adalah BeCl2, BCl3, dan AlBr3.
2. Senyawa dengan jumlah elektron valensi ganjil.
Contohnya adalah NO2, yang mempunyai elektron valensi (5 + 6 + 6) = 17. Kemungkinan rumus Lewis untuk NO2 sebagai berikut.
3. Senyawa yang melampaui hukum oktet.
Ini terjadi pada unsur-unsur periode 3 atau lebih yang sanggup menampung lebih dari 8 elektron pada kulit terluarnya (ingat, kulit M sanggup menampung sampai 18 elektron). Beberapa pola adalah PCl5, SF6, ClF3, IF7, dan SbCl5.
Perhatikan rumus Lewis dari PCl5, SF6, dan ClF3 berikut ini.
B. Kegagalan Aturan Oktet
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur postransisi yaitu unsur logam sesudah unsur transisi, contohnya Ga, Sn, dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +2. Begitu juga Bi yang mempunyai 5 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3. Pada umumnya, unsur transisi maupun unsur postransisi tidak memenuhi hukum oktet.
Referensi :
Anda kini sudah mengetahui Kaidah Oktet dan Aturan Duplet. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.
Referensi Lainnya :
[1] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.