Pengertian Keelektronegatifan Unsur Kimia, Cara Menentukan, Satu Golongan, Periode - Keelektronegatifan ialah suatu bilangan yang menyatakan kecenderungan suatu unsur menarik elektron dalam suatu molekul senyawa.
a. Dalam satu golongan dari atas ke bawah keelektronegatifan semakin berkurang.
b. Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah.
Penjelasan:
a. Tidak ada sifat tertentu yang sanggup diukur untuk menetukan/membandingkan keelektronegatifan unsur-unsur.
b. Energi ionisasi dan afinitas elektron berkaitan dengan besarnya daya tarik elektron. Semakin besar daya tarik elektron semakin besar energi ionisasi, juga semakin besar (semakin negatif) afinitas elektron.
Jadi, suatu unsur (misalnya fluor) yang mempunyai energi ionisasi dan afinitas elektron yang besar akan mempunyai keelektronegatifan yang besar.
Konsep keelektronegatifan ini pertama kali diajukan oleh Linus Pauling (1901 – 1994) pada tahun 1932.
Semakin besar keelektronegatifan, unsur cenderung makin gampang membentuk ion negatif. Semakin kecil keelektronegatifan, unsur cenderung makin sulit membentuk ion negatif, dan cenderung semakin gampang membentuk ion positif.
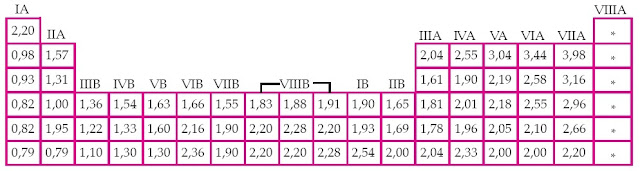
Akan tetapi perlu diingat bahwa golongan VIIIA tidak mempunyai keelektronegatifan. Hal ini alasannya ialah sudah mempunyai 8 elektron di kulit terluar. Makara keelektronegatifan terbesar berada pada golongan VIIA. [1]
Tabel 1. Skala Elektronegativitas Unsur-Unsur dalam Tabel Periodik Unsur
Anda kini sudah mengetahui Keelektronegatifan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Setyawati, A. A. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 186.
Referensi Lainnya :
[1] Utami, B. A. N. Catur Saputro, L. Mahardiani, dan S. Yamtinah, Bakti Mulyani.2009. Kimia : Untuk SMA/MA Kelas X. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 250.