Bunyi Hukum Faraday 1 dan 2 ihwal Elektrolisis Kimia, Rumus, Contoh Soal, Pembahasan - Seorang jago kimia Inggris berjulukan Michael Faraday pada awal tahun 1830-an menemukan bahwa larutan tertentu sanggup segera mengalirkan arus listrik. Ia menamakan larutan tersebut dengan elektrolit dan aliran listrik yang melalui larutan elektrolit disebut elektrolisis. Selanjutnya Michael Faraday melaksanakan percobaan untuk meneliti kekerabatan antara besarnya arus yang mengalir dalam suatu elektrolisis dengan jumlah zat yang bereaksi. Untuk menggambarkannya diambil elektrolisis larutan perak nitrat (AgNO3). Pada katode akan terjadi reaksi reduksi menyerupai berikut.
Ag+(aq) + e¯ → Ag(s)
Dari reaksi di atas sanggup dikatakan bahwa untuk menghasilkan 1 mol logam Ag, dibutuhkan 1 mol elektron.
Jumlah listrik yang dialirkan ke dalam sel elektrolisis untuk mendapat 1 mol elektron dinamakan 1 Faraday. Berdasarkan percobaan diperoleh bahwa 1 mol elektron mengandung muatan listrik sebesar 96500 Coulomb.
1 mol elektron = 1 Faraday = 96500 Coulomb
Sebagai hasil dari percobaannya pada tahun 1832 Faraday mengemukakan dua aturan yang penting ihwal kekerabatan antara arus listrik dengan jumlah zat yang terbentuk pada elektrode.
1. Hukum Faraday 1
Hukum Faraday 1 menyatakan bahwa massa zat yang dibebaskan pada suatu elektrolisis berbanding lurus dengan jumlah listrik yang mengalir.
Secara matematis sanggup dituliskan menyerupai berikut.
G ≈ Q ................. (1)
Keterangan :
G = massa zat yang dibebaskan (gram)
Q = jumlah listrik yang dipakai (Coulomb)
Apabila jumlah muatan listrik merupakan hasil kali berpengaruh arus (I) dengan waktu (t), maka persamaan di atas sanggup ditulis menyerupai berikut.
G = I . t ...................... (2)
Seperti kita ketahui bahwa dalam reaksi elektrolisis di katode terjadi reaksi reduksi dengan persamaan:
Ln+(aq) + n e¯ → L(s)
Untuk mengendapkan 1 mol L dibutuhkan sejumlah n mol elektron. Oleh alasannya itu, untuk mengendapkan sejumlah logam maka jumlah listrik yang dibutuhkan adalah.
Q = n (e¯) x F ............................. (3)
Keterangan :
F = Konstanta Faraday (96.500 C/mol)
n (e¯) = mol elektron
Jika persamaan (2) dan persamaan (3) kita substitusikan pada persamaan (1) maka diperoleh persamaan menyerupai berikut.
I . t = n (e¯) × 96.500
n (e¯) = (I . t) / 96.500
Banyaknya zat yang diendapkan selama elektrolisis dengan arus I ampere dan waktu t detik ialah menyerupai berikut.
Ln+(aq) + n e¯ → L(s)
n mol e¯ 1 mol L
Makara untuk menghitung massa logam yang terendapkan sanggup dilakukan dengan persamaan berikut ini.
G = mol x Ar =  x Ar
x Ar
G = 
Ar/n disebut juga massa ekuivalen (Me). Oleh alasannya itu, persamaan di atas sanggup juga ditulis menyerupai berikut.
G = Me x  .................. (4)
.................. (4)
Keterangan :
G = massa zat terendapkan (gr)
I = berpengaruh arus (ampere)
t = waktu (sekon)
Me= massa ekuivalen
n = muatan ion L (biloks)
Contoh Soal Hukum Faraday 1 (1) :
Elektrolisis larutan AgNO3 menggunakan elektrode platina, dengan berpengaruh arus 5 ampere selama 20 menit. Hitung massa perak yang mengendap pada katode!
Penyelesaian:
Diketahui :
I = 5 ampere
t = 20 menit = 1.200 detik
Me untuk perak = Ar / n = 107,9 / 1 = 107,9
Ditanya : G ...?
G = 
G = 
G = 6,71 gram
Jadi, perak yang mengendap pada katode ialah 6,71 gram.
Contoh Soal Hukum Faraday 1 (2) :
Diberikan reaksi sebagai berikut.
Zn2+(aq) + 2 e¯ → Zn(s)
Jika arus sebesar 10 ampere mengalir ke katode selama 10 menit, berapa banyak Zn yang terbentuk? (Ar Zn = 65)
Penyelesaian :
Diketahui :
I = 10 A
t = 10 menit = 600 sekon
Ar Zn = 65
Me = 65/2 = 32,5
Ditanya : GZn ... ?
Pembahasan :
G = 
G = 
G = 2,02 gram
Jadi, perak yang mengendap 2,02 gram.
Contoh Soal Hukum Faraday 1 (3) :
Pada elektrolisis leburan garam CaCl2 dengan elektrode karbon dipakai muatan listrik sebanyak 0,02 F. Hitung volume gas klorin yang dihasilkan di anode, bila diukur pada tekanan dan suhu di mana 1 liter gas N2 (Mr N2 = 28) massanya 1,4 gram!
Penyelesaian:
Elektrolisis leburan CaCl2
Katode : Ca2+(aq) + 2 e¯ → Ca(s)
Anode : 2 Cl¯(aq) → Cl2(g) + 2 e¯
Mol elektron = arus listrik = 0,02 mol
Mol Cl2 = 0,01 mol (lihat koefisien)
Menghitung volume gas Cl2, dengan membandingkan gas N2 pada suhu dan tekanan tertentu.
x = 0,2 L = 200 mL
Contoh Soal Hukum Faraday 1 (4) :
Arus listrik sebanyak 9.650 A (selama beberapa waktu) dialirkan melalui 1 liter larutan perak nitrat 1 M dalam sebuah sel elektrolisis. Bila kedua elektrode dibentuk dari platina, hitung pH larutan sesudah elektrolisis!
Penyelesaian :
Ionisasi AgNO3 : AgNO3
Reaksi elektrolisis AgNO3 sebagai berikut:
Katode : Ag+ (aq) + e¯ → Ag(s)
Anode : 2 H2O(l) → 4 H+(aq) + O2(g) + 4 e¯
Mol e¯ =  = 0,1 mol
= 0,1 mol
mol H+ ≈ mol e¯ (lihat koefisien reaksi)
(H+) = 0,1 mol / 1 liter = 0,1 M
pH = - log (H+) = log (0,1) = 1
2. Hukum Faraday 2
Hukum Faraday 2 menyatakan bahwa zat yang dibebaskan dalam elektrolisis berbanding lurus dengan massa ekuivalen zat itu.
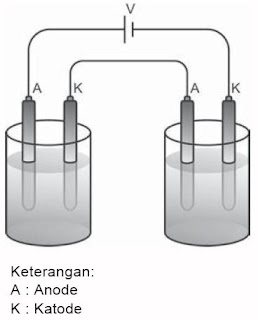 |
| Gambar 1. Rangkaian Dua Sel Elektrolisis dengan Sumber Listrik yang Sama. |
Secara matematis, pernyataan tersebut sanggup dituliskan menyerupai berikut.
G ≈ Me
Jika arus listrik yang sama dialirkan dalam dua buah sel elektrolisis yang berbeda maka perbandingan massa zat yang dibebaskan akan sama dengan perbandingan massa ekuivalennya. Oleh alasannya itu, berdasarkan aturan Faraday 2, massa zat terendapkan hasil dua buah elektrolisis dengan arus listrik yang sama secara matematis sanggup dituliskan menyerupai berikut.
Keterangan :
G = massa hasil elektrolisis (gram)
Me = massa ekuivalen
Contoh Soal Hukum Faraday 2 :
Pada dua elektrolisis, dengan sejumlah arus tertentu dalam waktu 2 jam dibebaskan 0,504 gram gas hidrogen (Ar H = 1). Hitung banyaknya gas oksigen (Ar = 16) yang sanggup dibebaskan oleh arus yang sama dalam waktu yang sama!
Penyelesaian
Diketahui :
GH2 = 0,504 gram
MeH2 = 1/1 = 1
MeO2 = 16/2 = 8
Ditanya : GO2 ...?
Jawaban :
GO2 = 4,032 gram
Anda kini sudah mengetahui Hukum Faraday. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.





