Prinsip, Cara Kerja Sel Elektrolisis, Larutan, Percobaan, Praktikum, Stoikiometri, Persamaan Reaksi Kimia - Sel volta menghasilkan arus listrik searah ketika reaksi redoks di dalam sel terjadi secara spontan. Adapun sel elektrolisis merupakan kebalikan dari sel volta, yakni menerapkan arus listrik searah untuk mendorong semoga terjadi reaksi elektrokimia di dalam sel.
1. Pengertian Elektrolisis
Kata elektrolisis berasal dari elektronik (listrik) dan analisa (uraian). Makara elektrolisis ialah proses pemisahan senyawa kimia lantaran adanya arus listrik. Pada dasarnya elektrolisis memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan, yang merupakan kebalikan dari elektrokimia. [1]
1. Pengertian Elektrolisis
Kata elektrolisis berasal dari elektronik (listrik) dan analisa (uraian). Makara elektrolisis ialah proses pemisahan senyawa kimia lantaran adanya arus listrik. Pada dasarnya elektrolisis memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan, yang merupakan kebalikan dari elektrokimia. [1]
2. Prinsip Elektrolisis
Elektrolisis artinya penguraian suatu zat akhir arus listrik. Zat yang terurai sanggup berupa padatan, cairan, atau larutan. Arus listrik yang digunakan ialah arus searah (direct current = DS). Tempat berlangsungnya reaksi reduksi dan oksidasi dalam sel elektrolisis sama menyerupai pada sel volta, yaitu anode (reaksi oksidasi) dan katode (reaksi reduksi). Perbedaan sel elektrolisis dan sel volta terletak pada kutub elektrode. Pada sel volta, anoda (–) dan katoda (+), sedangkan pada sel elektrolisis sebaliknya, anode (+) dan katode (–).
Pada sel elektrolisis anode dihubungkan dengan kutub positif sumber energi listrik, sedangkan katode dihubungkan dengan kutub negatif. Oleh lantaran itu pada sel elektrolisis di anode akan terjadi reaksi oksidasi dan di katode akan terjadi reaksi reduksi.
Percobaan Elektrolisis Air
Tujuan :
Mengetahui cara kerja dari sel elektrolisis.
Alat :
- Gelas kimia
- Elektrode karbon
- Tabung reaksi
- Baterai 6–12 volt
- Gelas ukur
- Kabel
Bahan :
- Air
- H2SO4 1M
Langkah Kerja :
- Pasang perangkat sel elektrolisis menyerupai Gambar 1.
- Tuangkan 250 mL air ke dalam gelas kimia, kemudian tambahkan 1 mL larutan H2SO4 1 M.
- Celupkan 2 buah elektrode karbon ke dalam gelas kimia besar dan isi dengan air hingga penuh.
- Hubungkan kedua elektrode itu dengan sumber arus searah (baterai atau adaptor) yang mempunyai GGL sekitar 6 – 12 volt.
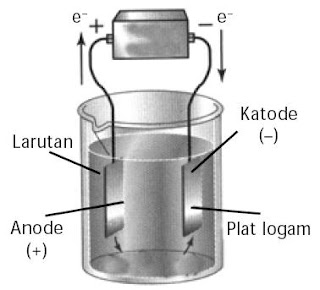 |
| Gambar 1. Sel elektrolisis. |
Pertanyaan :
- Mengapa dalam elektrolisis di atas harus ditambahkan H2SO4?
- Apa yang terjadi pada permukaan kedua elektrode?
- Apakah terbentuk gas dalam tabung reaksi? Berapakah perbedaan volume gas dalam tabung reaksi itu?
- Tuliskan reaksi redoks yang terjadi dalam sel elektrolisis.
- Simpulkan hasil pengamatan dari percobaan yang Anda lakukan dan diskusikan dengan guru Anda.
Ketika kedua elektrode karbon dihubungkan dengan sumber energi listrik arus searah, dalam sel elektrolisis terjadi reaksi redoks, yaitu penguraian air menjadi gas H2 dan gas O2.
Reaksi redoks yang terjadi dalam sel elektrolisis ialah :
Anode (+) | : | 2H2O(l) → O2(g) + 4H+(aq) + 4e– | (oksidasi O2–) |
Katode (–) | : | 4H2O(l) + 4e– → 2H2(g) + 4OH–(aq) | (reduksi H+) |
Reaksi | : | 2H2O(l) → 2H2(g) + O2(g) |
Berapakah perbandingan volume gas H2 dan O2 yang terbentuk pada kedua tabung reaksi?
Berdasarkan persamaan reaksi redoks sanggup diramalkan bahwa perbandingan volume gas H2 terhadap O2 adalah 2 : 1. Jika volume gas H2 20 mL, volume gas O2 adalah 10 mL.
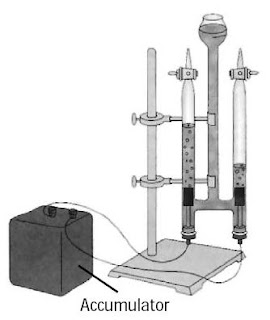 |
| Gambar 2. Sel elektrolisis Hoffman Gas-gas apa sajakah yang terbentuk pada setiap lengan dari sel Hoffman? |
Alat yang akurat untuk penyelidikan elektrolisis air ialah alat elektrolisis Hoffman (Gambar 2.). Alat ini dilengkapi elektrode platina dalam tabung penampung gas berskala sehingga volume gas hasil elektrolisis gampang diukur.
3. Elektrolisis Larutan
Elektrolisis larutan berbeda dengan elektrolisis air. Misalnya larutan NaI, terdapat ion Na+ dan ion I–. Kedua ion ini bersaing dengan molekul air untuk dielektrolisis. Di katode terjadi persaingan antara molekul H2O dan ion Na+ (keduanya berpotensi untuk direduksi). Demikian juga di anode, terjadi persaingan antara molekul H2O dan ion I– (keduanya berpotensi dioksidasi).
Spesi mana yang akan keluar sebagai pemenang?
Pertanyaan tersebut sanggup dijawab berdasarkan nilai potensial elektrode standar. Setengah reaksi reduksi di katode :
Na+(aq) + e– → Na(s) | E° = –2,71 V |
2H2O(l) + 2e– → H2(g) + 2OH–(aq) | E° = –0,83 V |
Berdasarkan nilai potensialnya, H2O lebih berpotensi direduksi dibandingkan ion Na+ sebab mempunyai nilai E° lebih besar. Perkiraan ini cocok dengan pengamatan, gas H2 dilepaskan di katode.
Setengah reaksi oksidasi di anode:
2I–(aq) → I2(g) + 2e– | E° = –0,54 V |
2H2O(l) → O2(g) + 4H+(aq) + 4e– | E° = –1,23 V |
Berdasarkan nilai potensial, ion I– memenangkan persaingan lantaran nilai E° lebih besar dibandingkan molekul H2O.
Reaksi yang terjadi pada sel elektrolisis:
Katode | : | 2H2O(l) + 2e– → H2(g) + 2OH–(aq) |
Anode | : | 2I–(aq) → I2(g) + 2e– |
Reaksi | : | 2H2O(l) + 2I–(aq) → H2(g) + I2(g) + 2OH–(aq) |
Percobaan / Praktikum Elektrolisis (2) : [1]
A. Tujuan
Memahami insiden elektrolisis dalam larutan kalium iodida (KI).
B. Alat dan Bahan
- Tabung U
- Gelas kimia
- Elektrode karbon
- Baterai dan wadahnya
- Kabel
- Pipet tetes
- Tabung reaksi
- Kertas lakmus merah
- Kertas lakmus biru
- Indikator fenol ptealin (PP)
- Larutan kalium iodida (KI) 0,5 M
- Larutan amilum
C. Cara Kerja
1. Isi tabung U dengan larutan KI 0,5 M hingga ¾ tinggi.
2. Masukkan elektrode karbon ke dalam kedua kaki tabung U dan hubungkan kedua elektrode dengan baterai selama ± 5 menit.
3. Ambil larutan pada ruang katode dan anode. Selanjutnya masukkan dalam tabung reaksi yang berbeda. Bagilah menjadi empat tabung reaksi dan tambahkan amilum pada dua tabung dan dua tabung yang lain tambahkan indikator pp.
Tabung I : Larutan dari anode + 3 tetes larutan amilum
Tabung II : Larutan dari anode + 3 tetes indikator PP
Tabung III : Larutan dari katode + 3 tetes larutan amilum
Tabung IV : Larutan dari katode + 3 tetes indikator PP
4. Amati perubahan yang terjadi!
D. Hasil Percobaan
| Larutan dalam | Warna Larutan | ||
| Mula-mula | Setelah ditambah amilum | Setelah ditambah PP | |
| Anode | | | |
| Katode | | | |
E. Analisa Data
- Mengapa terjadi perubahan warna sesudah ditambahkan amilum?
- Bagaimana reaksi yang terjadi pada anode? Dan apakah zat yang terbentuk di anode?
- Mengapa terjadi perubahan warna sesudah ditambahkan fenol Ptalein (PP)?
- Bagaimana reaksi yang terjadi pada katode? Dan apakah zat yang terbentuk di katode?
- Apakah kesimpulan dari percobaan ini?
Dari percobaan di atas larutan KI dielektrolisis dengan elektrode karbon (grafit). Pada larutan KI terionisasi menjadi K+ dan I¯. Pada tabung reaksi yang telah diberi larutan PP maka larutan dari anode akan berkembang menjadi merah. Hal ini disebabkan K+ bergerak pada katode, sehingga elektron akan masuk pada larutan. Kation direduksi di katode adalah H2O, sehingga terjadi reduksi terhadap H2O.
2H2O(l) + 2e¯ → H2(g) + 2OH¯(aq)
Adanya ion OH¯ pada katode ini ditunjukkan adanya warna merah. Adapun pada anode terjadi reaksi oksidasi di mana ion negatif (I¯) yang berasal dari larutan bergerak menuju elektrode positif, selanjutnya ion I¯ melepaskan elektron di sekitar elektrode positif dan mengalir ke kutub negatif. Makara ion I¯ melepaskan elektron di sekitar elektode positif dan mengalir ke kutub negatif, sehingga akan terjadi reaksi menyerupai berikut.
2I¯(aq) → I2(g) + 2e¯
Adanya I2 dapat diuji dengan amilum. Jika larutan ditetesi amilum berubah warna menjadi ungu berarti dalam larutan tersebut terdapat I2.
Seperti halnya pada reaksi elektrokimia, reaksi elektrolisis merupakan adonan reaksi di anode dan katode. Pada reaksi elektrolisis di katode akan mengalami reaksi reduksi, sedangkan di anode akan mengalami reaksi oksidasi.
Pada percobaan di atas reaksi yang terjadi sanggup dituliskan menyerupai berikut.
| Anode | : | 2 I¯(aq) → I2(g) + 2 e¯ |
| Katode | : | 2 H2O(l) + 2 e¯ → H2(g) + 2 OH¯(aq) |
| | | 2 I¯(aq) + 2 H2O(l) → I2(g) + H2(g) + 2 OH¯(aq) |
Makara pada elektolisis KI, di anode dihasilkan I2 dan pada katode dihasilkan H2.
Berikut hal-hal yang berkaitan dengan elektrolisis.
1. Reaksi pada Katode
Oleh lantaran katode bermuatan negatif maka pada katode terjadi reaksi reduksi. Reaksi di katode bergantung jenis kation dalam larutan.
a. Kation sanggup berasal dari golongan alkali, alkali tanah, Al atau Mn yaitu ion-ion logam yang mempunyai elektrode lebih dari kecil atau lebih negatif daripada pelarut (air), sehingga air yang tereduksi.
Reaksi yang terjadi sanggup dituliskan menyerupai berikut.
2H2O(l) + 2e¯ → 2OH¯(aq) + H2(g)
b. Ion-ion logam yang mempunyai E° lebih besar dari -0,83 direduksi menjadi logam yang diendapkan pada permukaan katode.
M+ + e¯ → M
c. Ion H+ dari asam direduksi menjadi gas hidrogen (H2)
2H+(aq) + 2e¯ → H2(g)
d. Apabila di dalam elektrolisis yang digunakan ialah leburan, maka akan terjadi reaksi menyerupai berikut.
Mn2+ + e¯ → M
2. Reaksi pada Anode
Oleh lantaran anode bermuatan positif maka pada anode terjadi reaksi oksidasi.
a. Ion-ion sisa asam oksi, misalnya SO42¯ dan NO3¯ tidak teroksidasi maka yang dioksidasi ialah air.
2H2O(l) → 4H+(aq) + 4e¯ + O2(g)
b. Ion-ion halida yaitu F–, Br–, I¯ dioksidasi menjadi halogen (X2) yaitu F2, Cl2, Br2, I2 dengan reaksi menyerupai berikut.
2X¯ → X2 + 2e¯
c. Ion OH¯ dari basa yang dioksidasi menjadi gas oksigen (O2).
4OH¯(aq) → 2H2O(l) + 4e¯ + O2(g)
3. Bahan Elektrode
a. Apabila dalam reaksi elektrolisis memakai elektrode terbuat dari grafit (C) atau logam inert, maka elektrode tersebut tidak bereaksi.
b. Apabila elektrode terbuat dari logam aktif misal Cu maka anode tersebut akan mengalami oksidasi. Reaksi yang terjadi menyerupai berikut.
M → Mn+ + n e¯
Bagaimana reaksi redoks dalam sel elektrolisis? Pada ketika sel elektrolisis dihubungkan dengan sumber arus listrik maka anion yaitu ion negatif dalam elektrolit ditarik ke anode yang bermuatan positif. Adapun kation yaitu ion positif ditarik ke katode yang bermuatan negatif. Ion yang bereaksi di elektrode menjadi tidak bermuatan. Elektron mengalir dari anode ke baterai dan dari baterai ke katode.
Contoh Soal Menentukan Reaksi Redoks dalam Sel Elektrolisis :
Tuliskan reaksi sel elektrolisis untuk larutan ZnSO4.
Jawaban :
Di anode terjadi persaingan antara ion SO42– dan H2O dan di katode terjadi persaingan antara ion Zn2+ an H2O.
Untuk mengetahui pemenangnya sanggup dilihat data potensial reduksi standar.
Di katode (+) : reaksi reduksi
Zn2+(aq) + 2e– → Zn(s) | E° = –0,76 V |
2H2O(l) + 2e– → H2(g) + 2OH-(aq) | E° = –0,83 V |
Di anode (–) : reaksi oksidasi
2SO42–(aq) → S2O82–(aq) + 2e– | E° = –2,01 V |
2H2O(l) → O2(g) + 4H+(aq) + 4e– | E° = –1,23 V |
Berdasarkan data potensial di atas, di katode terjadi reduksi ion Zn2+ dan di anode terjadi oksidasi H2O. Persamaan reaksinya :
Katode | : | 2Zn2+(aq) + 4e– → 2Zn(s) |
Anode | : | 2H2O(l) → O2(g) + 4H+(aq) + 4e– |
Reaksi | : | 2ZnSO4(aq) + 2H2O(l) → 2Zn(s) + O2(g) + 2H2SO4(aq) |
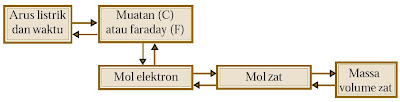
4. Stoikiometri Elektrolisis
Michael Faraday ialah seorang pakar Kimia-Fisika Inggris. Faraday menyatakan bahwa sel elektrolisis sanggup digunakan untuk memilih banyaknya zat yang bereaksi berdasarkan jumlah muatan listrik yang digunakan dalam rentang waktu tertentu.
Dalam sel volta maupun sel elektrolisis terdapat kekerabatan kuantitatif antara jumlah zat yang bereaksi dan muatan listrik yang terlibat dalam reaksi redoks. Pernyataan ini merupakan prinsip dasar Hukum Faraday, yaitu :
- Dalam sel elektrokimia, massa zat yang diendapkan pada suatu elektrode sebanding dengan besarnya muatan listrik (aliran elektron) yang terlibat di dalam sel.
- Massa ekuivalen zat yang diendapkan pada elektrode akan setara jikalau muatan listrik yang dialirkan ke dalam sel sama.
Aliran listrik tiada lain ialah aliran elektron. Oleh lantaran itu, muatan listrik yang terlibat dalam sel elektrokimia sanggup ditentukan berdasarkan muatan elektron yang terlibat dalam reaksi redoks pada sel elektrokimia.
Berdasarkan hasil penyelidikan Millikan (model tetes minyak), diketahui bahwa muatan elektron :
e = 1,60218 × 10–19 C.
Oleh lantaran itu, muatan listrik yang terjadi jikalau satu mol elektron ditransfer ialah :
Q = (6,022 × 1023 mol–1) (1,60218 x 10–19 C) = 96.485 C mol–1
Nilai muatan listrik untuk satu mol elektron ditetapkan sebesar satu faraday, dilambangkan dengan F, yaitu:
F = 96.485 C mol–1
Arus listrik sebesar i ampere yang mengalir selama t detik menghasilkan muatan listrik :
Q = i × t coulomb.
Dalam satuan Faraday, besarnya muatan listrik (Q) tersebut ialah sebagai berikut.
Q =  faraday
faraday
Berdasarkan Hukum I Faraday, jikalau muatan listrik sanggup dihitung maka massa zat yang bereaksi di elektrode sanggup ditentukan.
Tinjaulah elektrolisis lelehan NaCl. Jika lelehan NaCl dielektrolisis, ion-ion Na+ bermigrasi menuju anode dan ion-ion Cl– bermigrasi menuju anode.
Katode (–) : Na+(l) + e– → Na(s)
Anode (+) : Cl–(l) → ½ Cl2(g) + e–
Untuk mereduksi satu mol ion Na+ diperlukan satu mol elektron atau diharapkan muatan sebesar satu faraday, yaitu 96.485 C mol–1. Besarnya muatan ini sanggup ditentukan dari jumlah arus listrik yang mengalir dan usang waktu elektrolisis : Q = i (A) × t (detik).
Secara umum, tahap-tahap perhitungan stoikiometri elektrolisis ditunjukkan pada diagram berikut. Perhitungan sanggup dimulai dari arus listrik yang mengalir selama waktu tetentu atau jumlah zat yang terlibat dalam reaksi redoks.
Massa ekuivalen zat (meq) ialah massa relatif zat per satuan muatannya.
Contoh :
Cu2+ + 2e- → Cu(s)
meq (Cu) = 63, 5 / 2 = 31,75
Contoh Soal Menghitung Berat Zat yang Diendapkan dalam Sel Elektrolisis
1. Hitunglah massa Cu yang sanggup diendapkan di katode jikalau arus listrik 2 A dialirkan ke dalam sel elektrolisis larutan Cu2+ selama 10 menit. Diketahui Ar Cu = 63,5.
2. Dalam elektrolisis larutan CuSO4, 2 g logam Cu diendapkan pada katode. Berapakah arus listrik yang dialirkan selama 30 menit?
Pembahasan :
1. Tahap 1: Tentukan muatan listrik yang digunakan
Q = i × t = 2 A x 600 s = 1.200 C
Tahap 2: Tentukan jumlah mol elektron yang setara dengan muatan listrik
1 mol e– = 1 faraday = 96.485 C mol–1
Jumlah mol elektron untuk 1.200 C = 1.200 C / 96.485 C mol–1 = 12,4 x 10–3 mol
Tahap 3: Elektron yang mengalir digunakan untuk mereduksi ion Cu2+ menurut persamaan:
Cu2+(aq) + 2e- → Cu(s)
Jadi, 12,4 x 10–3 mol elektron sanggup mengendapkan ion Cu2+ sebanyak :
(1 mol Cu2+ / 2 mol e-) x 12,4 x 10–3 mol e- = 6,2 x 10–3 mol
Jadi, jumlah ion Cu2+ yang diendapkan sebanyak 6,2 x 10–3 mol.
Tahap 4: Massa Cu yang diendapkan di katode sebesar 6,2 x Cu2+ mol x 63,5 g mol–1 = 0,395 g
2. Jumlah mol Cu = 2g / 63,5 gmol–1 = 0,03 mol
Jumlah mol elektron yang digunakan:
Cu2+(aq) + 2e- → Cu(s)
(2 mol e- / 1 mol Cu2+) x 0,03 mol Cu = 0,06 mol e–
Muatan listrik yang digunakan :
0,06 mol x 96.485 C mol–1 = 5.789 C
Jumlah arus listrik yang dialirkan selama 30 menit:
Q = i . t → 5.789 C = i x 1.800 detik
i = 3,2 A
Jadi, arus listrik yang harus dialirkan selama 30 menit ialah 3,2 A.
Jika sejumlah sel elektrolisis dirangkaikan secara seri, menyerupai ditunjukkan pada Gambar 3, bagaimanakah kekerabatan muatan dan berat ekuivalen zat?
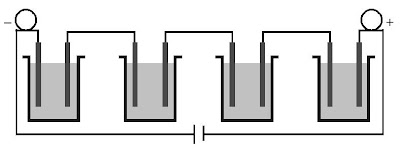 |
| Gambar 3. Elektrolisis beberapa larutan yang dirangkaikan secara seri. Apakah elektrolisis beberapa larutan sanggup dirangkaikan secara paralel? |
Menurut Hukum II Faraday, massa ekuivalen zat yang diendapkan akan sama jikalau muatan listrik yang mengalir tetap. Hubungan massa ekuivalen dan massa zat (dalam satuan gram) yang diendapkan di katode dirumuskan sebagai berikut.
Massa zat = meq . i . t / F
dengan meq adalah massa ekuivalen, i arus listrik yang dialirkan (ampere), dan t ialah waktu elektrolisis (detik). Oleh lantaran pada rangkaian sel secara seri, arus listrik yang mengalir ke dalam setiap sel tetap, Anda sanggup memilih berat zat dalam setiap sel elektrolisis dengan zat yang berbeda.
Contoh Soal Penerapan Hukum II Faraday
1. Dua buah sel elektrolisis dirangkaikan secara seri, sel pertama mengandung CuSO4 1 M dan sel kedua mengandung CuSO4 2 M. Hitunglah massa Cu yang diendapkan pada setiap sel jikalau arus yang dialirkan sebesar 0,5 A selama 10 menit. Diketahui Ar Cu = 63,5.
2. Jika larutan CuSO4 dan AgNO3 dirangkaikan secara seri, kemudian dielektrolisis dan mengalami setengah reaksi reduksi sebagai berikut.
Ag+(aq) + e– → Ag(s)
Cu2+(aq) + 2e– → Cu(s)
Berapakah massa Cu yang diendapkan jikalau dalam sel elektrolisis AgNO3 ditemukan 10 g perak?
Diketahui Ar Ag = 107, Cu = 63,5.
Penyelesaian :
1. Menurut Hukum II Faraday :
Oleh lantaran sel dirangkaikan secara seri, arus yang mengalir tetap sehingga massa ekuivalen Cu sama dalam setiap sel.
Endapan Cu dalam kedua sel sama lantaran arus yang mengalir tetap.
Massa Cu = meq . i . t / F =  = 0,987 g
= 0,987 g
2. Massa Ag = meq . i . t / F
10 g = 
Massa Cu = (63,5 / 2) x 0,039 C= 2,967 g
Prinsip elektrolisis banyak diterapkan dalam pelapisan logam dengan logam yang lebih baik (electroplating), juga dalam pengolahan dan pemurnian logam.
a. Penyepuhan (electroplating)
Penyepuhan (electroplating) ialah suatu metode elektrolisis untuk melapisi permukaan logam oleh logam lain yang lebih stabil terhadap cuaca atau untuk menambah keindahannya. Contohnya, besi dilapisi nikel semoga tahan karat, tembaga dilapisi perak atau emas semoga lebih bernilai.
Logam besi banyak digunakan untuk banyak sekali aplikasi, tetapi tidak tahan terhadap cuaca sehingga gampang berkarat. Agar besi tahan terhadap karat maka permukaan besi sering dilapisi oleh logam yang lebih stabil, menyerupai seng, nikel, atau perak.
Dalam praktiknya, besi dicelupkan ke dalam sel berisi larutan logam yang akan dilapiskan. Agar logam mengendap pada besi maka besi dijadikan sebagai katode. Lakukan oleh Anda percobaan berikut.
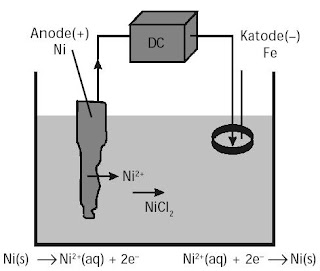
Praktikum Penyepuhan Besi dengan Nikel
Tujuan :
Melakukan penyepuhan besi dengan nikel.
Alat :
- Bejana
- Batang nikel
- Sumber arus
- Cincin besi
Bahan :
NiCl2 1M
Langkah Kerja :
1. Buatlah dalam kelompok kerja Anda perangkat sel elektrolisis menyerupai yang ditunjukkan pada gambar berikut.
2. Siapkan larutan NiCl2 1M dalam suatu baskom dan batang nikel berikut lempengan yang akan dikerjakan.
3. Celupkan lempengan dan batang nikel ke dalam larutan dan hubungkan dengan arus listrik searah. Cincin besi ditempatkan sebagai katode (–) dan batang nikel sebagai anode (+).
4. Amatilah proses yang terjadi.
Pertanyaan :
- Jelaskan proses yang terjadi pada penyepuhan logam tersebut?
- Presentasikan hasil pengamatan kelompok Anda di depan kelas.
b. Pemurnian Logam
Prinsip elektrolisis banyak diterapkan pada pengolahan dan pemurnian logam. Contoh, logam aluminium diolah dan dimurnikan secara elektrolisis dari mineral bauksit. Logam tembaga diolah melalui pemanggangan tembaga (II) sulfida, kemudian dimurnikan secara elektrolisis.
Logam tembaga yang akan dimurnikan ditempatkan sebagai anode dan logam tembaga murni ditempatkan sebagai katode, keduanya dicelupkan dalam larutan CuSO4, seperti ditunjukkan pada Gambar 4.
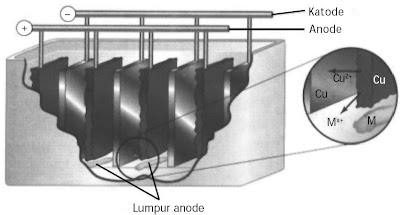 |
| Gambar 4. Pemurnian tembaga memakai elektrolisis. |
Selama elektrolisis terjadi reaksi sebagai berikut.
Anode (+) : Cu(s) → Cu2+(aq) + 2e–
Katode (–) : Cu2+(aq) + 2e– → Cu(s)
Logam-logam pengotor yang kurang reaktif, menyerupai emas, perak, dan platina membentuk endapan lumpur di dasar sel anode. Adanya logam-logam yang lebih reaktif, seperti Zn2+, dan Ni2+ tetap berada dalam larutan sebagai ion-ionnya.
Anda kini sudah mengetahui Cara Kerja Sel Elektrolisis. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Referensi Lainnya :
[1] Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.