Kelimpahan dan Sifat-sifat Aluminium, Unsur, Senyawa, Kimia - Aluminium berada dalam golongan IIIA pada sistem periodik dengan elektron valensi ns2 np1, dan bilangan oksidasi +3. Aluminium pada umumnya membentuk senyawa kovalen. Senyawa ion aluminium sangat terbatas, misalnya AlF3.
1. Kelimpahan Aluminium di Alam
Aluminium merupakan unsur dengan kelimpahan pada urutan ketiga dalam kerak bumi (setelah oksigen dan silikon). Aluminium terutama terdapat dalam mineral aluminosilikat yang ditemukan berasal dari batuan kulit bumi. Akibat perubahan alam, batuan ini membentuk lempung yang mengandung aluminium.
Setelah melalui proses alam yang panjang dan lama, lempung tersebut menghasilkan deposit bauksit, suatu bijih aluminium yang mengandung AlO(OH) dan Al(OH)3 dalam banyak sekali komposisi. Corundum ialah mineral keras yang mengandung aluminium oksida, Al2O3. Oksida aluminium murni tidak berwarna, tetapi akhir adanya pengotor sanggup menghasilkan banyak sekali warna. Contohnya menyerupai pada safir berwarna biru dan ruby berwarna merah tua.
2. Sifat-Sifat Unsur Aluminium
Berdasarkan potensial reduksi standar (E° = – 1,66), aluminium gampang teroksidasi menjadi aluminium oksida, Al2O3. Oksida ini membentuk lapisan tipis pada permukaan aluminium dan bersifat inert terhadap oksidasi sehingga lapisan oksida ini bisa mencegah terjadinya oksidasi berkelanjutan (pasivasi).
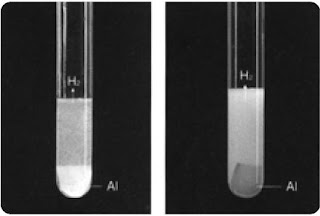
Aluminum sanggup bereaksi secara eksklusif dengan halogen membentuk aluminium halida disertasi pelepasan gas hidrogen.
2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g)
Dengan asam nitrat, aluminium tidak bereaksi alasannya ada lapisan oksida yang tahan terhadap asam nitrat.
Tabel 1. Sifat Fisika dan Kimia Aluminium
Sifat Sifat | Aluminium |
Titik leleh (°C) | 660 |
Titik didih (°C) | 2467 |
Massa jenis (gcm–3) | 2,70 |
Keelektronegatifan | 1,5 |
Jari-jari ion (Å) | 0,68 |
Jari-jari kovalen (Å) | 1,25 |
Potensial reduksi (V) | 1,66 |
Aluminium hidroksida larut dalam asam membentuk ion Al3+, dan dalam basa berlebih membentuk ion aluminat, Al(OH)4–.
Al(OH)3(s) + 3H+(aq) → Al3+(aq) + 3H2O(l)
Al(OH)3(s) + OH–(aq) → Al(OH)4(aq)
Dengan demikian, aluminium hidroksida ialah suatu amfoter.
Percobaan / Praktikum Identifikasi Sifat Amfoter Aluminium
Tujuan :
Membuktikan sifat amfoter dari aluminium.
Alat :
- Gelas kimia
- Tabung reaksi
- Gelas ukur
- Kertas saring
Bahan :
- AlCl3 0,1M
- NaOH 0,5 M dan 1 M
- HCl 1M
Langkah Kerja :
- Masukkan 25 mL AlCl3 0,1 M ke dalam gelas kimia.
- Tambahkan NaOH 0,5 M hingga terbentuk endapan. Kemudian, kocok.
- Saring endapan yang terbentuk. Masukkan ke dalam dua tabung reaksi masing-masing 1 g.
- Tambahkan 3 mL larutan HCl 1 M ke dalam tabung 1.
- Tambahkan 3 mL larutan NaOH 1 M ke dalam tabung 2.
- Amati kedua tabung tersebut.
Pertanyaan :
- Tuliskan semua persamaan reaksi yang terjadi.
- Bagaimanakah bentuk endapan hasil reaksi AlCl3 dan NaOH?
- Reaksi apakah yang terjadi antara HCl dan endapan; NaOH dan endapan?
- Apakah yang sanggup Anda simpulkan dari percobaan ini? Diskusikan dengan teman kelompok Anda. Kemudian, presentasikan di depan kelas.
Bauksit sebagai Sumber Aluminium
Aluminium merupakan logam yang sulit diekstrasi dari bijihnya. Aluminium dihasilkan dari elektrolisis lelehan bauksit. Di Indonesia, Bauksit termasuk dari 10% komoditi eksport yang berkaitan dengan pertambangan. Total produksi bauksit Indonesia sebanyak 1.160.000 ton per tahun. (Sumber : Encarta:Reference Library, 2005.)
Contoh Soal Mengidentifikasi Senyawa Aluminium :
Suatu larutan diduga mengandung NaCl(aq), MgCl2(aq), atau AlCl3(aq). Bahan uji kimia apakah untuk mengidentifikasi larutan ini? Anda hanya sanggup memakai satu zat.
Jawaban :
Tambahkan NaOH(s) tetes demi tetes ke dalam larutan. Jika NaOH(s) ditambahkan pada AlCl3(aq), endapan putih Al(OH)3 terbentuk. Penambahan NaOH secara berlebih akan melarutkan kembali endapan yang terbentuk menghasilkan aluminat yang larut, Na[Al(OH)4].
Jika NaOH ditambahkan ke dalam larutan MgCl2, padatan putih Mg(OH)2 terbentuk. Penambahan NaOH berlebih tidak melarutkan endapan yang terbentuk. Larutan NaCl tidak memperlihatkan endapan dengan ditambahkannya NaOH.
Contoh Soal Mengidentifikasi Senyawa Aluminium :
Suatu larutan diduga mengandung NaCl(aq), MgCl2(aq), atau AlCl3(aq). Bahan uji kimia apakah untuk mengidentifikasi larutan ini? Anda hanya sanggup memakai satu zat.
Jawaban :
Tambahkan NaOH(s) tetes demi tetes ke dalam larutan. Jika NaOH(s) ditambahkan pada AlCl3(aq), endapan putih Al(OH)3 terbentuk. Penambahan NaOH secara berlebih akan melarutkan kembali endapan yang terbentuk menghasilkan aluminat yang larut, Na[Al(OH)4].
Jika NaOH ditambahkan ke dalam larutan MgCl2, padatan putih Mg(OH)2 terbentuk. Penambahan NaOH berlebih tidak melarutkan endapan yang terbentuk. Larutan NaCl tidak memperlihatkan endapan dengan ditambahkannya NaOH.
Anda kini sudah mengetahui Aluminium. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.