Pembuatan dan Kegunaan Amonia, Asam Nitrat dan Sulfat, Hidrogen Sulfida, Belerang Oksida, Senyawa Kimia - Amonia, NH3 merupakan senyawa komersial penting dari nitrogen. Amonia ialah gas tidak berwarna dan berbau menyengat. Amonia dibentuk secara komersial melalui proses Haber dari N2 dan H2. Gambar 1. menawarkan diagram alir pembuatan amonia secara industri dari gas alam, uap, dan udara.
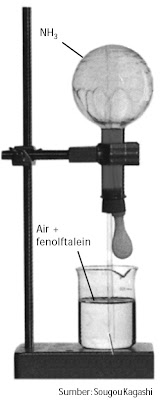 |
| Gambar 1. Amonia fontain Jika pipet dipijit-pijit, air akan naik ke dalam labu membentuk air mancur berwarna merah. Warna merah tersebut akibat NH3 (basa) larut dalam air. |
Amonia gampang dicairkan dan cairannya dipakai sebagai pupuk nitrogen. Garam amonium, menyerupai sulfat dan nitrat juga dipakai sebagai pupuk. Sejumlah besar amonia diubah menjadi urea, CO(NH2)2, yang dipakai sebagai pupuk, perhiasan masakan ternak, dan industri plastik formaldehid.
Asam nitrat, HNH3 adalah asam yang penting bagi industri dan dipakai untuk materi peledak, nilon, dan plastik poliuretan. Asam nitrat dibentuk secara komersial melalui proses Ostwald (Gambar 2).
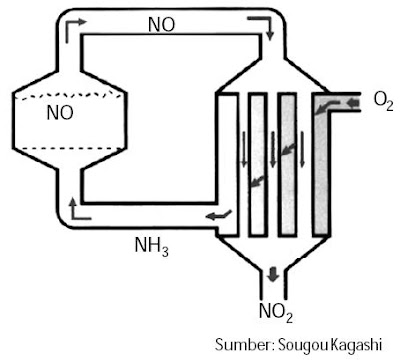 |
| Gambar 2. Diagram proses Ostwald tahap 1 dan tahap 2. |
Dalam proses Ostwald, asam nitrat dibentuk dari oksidasi amonia. Proses secara umum, amonia dibakar dengan adanya katalis platina menjadi gas NO dan diubah lebih lanjut menjadi NO2, kemudian dilarutkan dalam air menjadi asam nitrat.
| | | | Pt | |
| Tahap (1) | : | 4NH3(g) + 5O2(g) | → | 4NO(g) + 6H2O(g) |
| | | | | |
| Tahap (2) | : | 2NO(g) + O2(g) | → | 2NO2(g) |
| | | | | |
| Tahap (3) | : | 3NO2(g) + H2O(l) | → | 2HNO3(aq) + NO(g) |
Gas NO pada tahap selesai sanggup dipakai kembali.
Hidrogen sulfida (H2S) ialah gas tak berwarna dengan anyir telur busuk yang berpengaruh dan bersifat racun. Dalam larutan asam, H2S berperan sebagai reduktor menghasilkan belerang.
2Fe3+(aq) + H2S(g) → 2Fe2+(aq) + 2H+(aq) + S(s)
Belerang dioksida (SO2) ialah gas tak berwarna dengan anyir menyengat, diperoleh dari pembakaran sulfur atau sulfida. Belerang dioksida dipakai untuk mengawetkan buah-buahan kering, yaitu untuk menghambat pertumbuhan jamur.
Asam sulfat dibentuk dari sulfur melalui proses kontak. Proses tersebut terdiri atas pembakaran sulfur menjadi SO2 dan dioksidasi lanjut menjadi SO3 dengan katalis platina atau V2O5. Gas SO3 yang terbentuk dilarutkan dulu dalam asam sulfat kemudian diencerkan.
| Tahap (1) | : | S(s) + O2(g) | → | SO2(g) |
| | | | ∆/V2O5 | |
| Tahap (2) | : | 2SO2(g) + O2(g) | → | 2SO3(g) |
| | | | | |
| Tahap (3) | : | SO3(g) + H2O(l) | → | H2SO4(aq) |
Asap sulfur trioksida yang dihasilkan pada tahap (2) sukar larut dalam air sehingga SO3 dilarutkan lebih dulu dalam asam sulfat pekat membentuk asam pirosulfat (H2S2O7), kemudian diencerkan dengan air menghasilkan asam sulfat pekat.
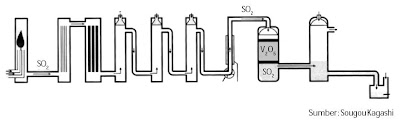 |
| Gambar 3. Diagram singkat proses kontak pada pembuatan asam sulfat. |
Asam sulfat pekat berupa cairan kental dan bersifat sanggup menarik molekul H2O dari udara maupun dari senyawa (higroskopis). Asam pekat juga tergolong oksidator kuat.
Asam sulfat dipakai untuk menciptakan pupuk fosfat dan amonium fosfat yang larut dalam air. Asam sulfat juga dipakai dalam pemurnian minyak bumi dan banyak industri kimia lainnya.
Anda kini sudah mengetahui Amonia, Asam Nitrat, Asam Sulfat, Hidrogen Sulfida, Belerang Oksida. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.





