Sifat-sifat Unsur Kimia, Gas Mulia, Halogen, Alkali Tanah, Periode Ketiga 3, Transisi, Logam, Praktikum, Percobaan - Sifat-sifat unsur sangat ditentukan oleh konfigurasi elektronnya. Unsur-unsur dalam sistem periodik disusun berdasarkan kenaikan nomor atom dan berdasarkan konfigurasi elektronnya. Unsur-unsur yang mempunyai susunan elektron terluar sama mempunyai sifat kimia yang sama dan dimasukkan dalam satu golongan, dan unsur-unsur yang mempunyai jumlah kulit yang sama dimasukkan dalam satu periode. Oleh lantaran itu, pada belahan ini akan dibahas sifat-sifat unsur berdasarkan golongan dan berdasarkan periode. Sifat-sifat tersebut mencakup sifat fisis dan sifat kimia, menyerupai penampilan, kelarutan, titik didih, titik leleh, kekerasan, jari-jari atom, kereaktifan, dan sifat khusus lainnya.
1. Gas Mulia
Unsur-unsur gas mulia dalam sistem periodik menempati golongan VIII A yang terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe) dan Radon (Rn). Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh lantaran itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban).
Pada tahun 1962 Neil Bartlett berhasil mensintesis senyawa gas mulia yaitu XePtF6. Dalam waktu yang singkat andal kimia yang lain memperlihatkan bahwa Xenon sanggup bereaksi pribadi dengan Fluor membentuk XeF2, XeF4, dan XeF6. Sejak dikala itu istilah inert tidak lagi sesuai dan para andal kimia mulai menyebut dengan golongan gas mulia.
a. Sifat-sifat fisis / fisika Gas Mulia
Sifat-sifat fisis gas mulia berubah secara periodik menyerupai terlihat pada tabel berikut.
Tabel 1. Sifat-Sifat Fisis Gas Mulia
Sifat | Helium | Neon | Argon | Kripton | Xenon | Radon |
• Nomor atom (Z) | 2 | 10 | 18 | 36 | 54 | 86 |
• Konfigurasi elektron | 1s2 | 1s22p2 | 3s23p6 | 4s24p6 | 5s25p6 | 6s26p6 |
• Titik cair (°C) | -272,2 | -248,6 | -189,4 | -157,2 | -111,8 | -71 |
• Titik didih (°C) | -268,9 | -246,0 | -185,9 | -153,4 | -108,1 | -62 |
• Rapatan (g/cm3) | 0,178 | 0,900 | 1,78 | 3,73 | 5,89 | 9,73 |
• Energi pengion (ev) | 24,6 | 21,6 | 15,8 | 14,0 | 12,1 | 10,7 |
• Jari-jari atom (Å) | 0,50 | 0,65 | 0,95 | 1,10 | 1,30 | 1,45 |
• Keelektronegatifan | 2,7 | 4,4 | 3,5 | 3,0 | 2,6` | 2,4 |
1) Wujud gas mulia
Unsur gas mulia terdapat sebagai gas tak berwarna yang monoatomik, ini akrab kaitannya dengan struktur elektron oktet dan duplet dari gas mulia. Sedangkan wujud gas pada suhu kamar disebabkan titik cair dan titik didih gas mulia yang rendah.
2) Titik cair dan titik didih
Titik cair dan titik didih gas mulia meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar atom gas mulia sesuai bertambahnya massa atom relatif (Ar).
3) Kelarutan
Kelarutan gas mulia dalam air bertambah besar dari Helium (He) hingga Radon (Rn). Pada suhu 0 °C dalam 100 ml air terlarut 1 ml He, 6 ml Ar, dan 50 ml Rn.
b. Sifat-sifat kimia gas mulia
Selama bertahun-tahun unsur gas mulia disebut sebagai gas inert. Sejak penemuan XePtF6 oleh Neil Bartlett anggapan gas inert gugur. Energi ionisasi kripton, Xenon dan Radon hampir sama dengan energi ionisasi oksigen dan masih lebih rendah dari fluor. Oleh lantaran itu dimungkinkan tiga unsur tersebut sanggup membentuk senyawa dan telah dibuktikan oleh Bartlett.
Radon sanggup bereaksi impulsif dengan fluor pada suhu kamar. Sementara Xenon memerlukan pemanasan atau permulaan reaksi secara fotokimia. Xenon sanggup bereaksi dengan Fluor pada suhu 400 °C dan tekanan 6 atmosfer.
400 oC | ||
Xe + 2Fe | → | XeF4 |
Kripton bereaksi dengan Fluor hanya jika keduanya dikenakan penyinaran atau pelepasan muatan listrik.
Terbentuknya senyawa gas mulia sanggup dijelaskan dengan hibridisasi.
Perhatikan pembentukan ikatan XeF2
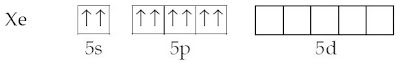
Struktur elektron Xe sanggup dituliskan :
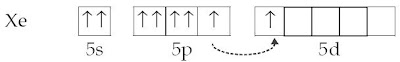
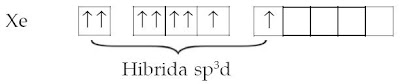
Untuk membentuk XeF2 satu elektron 5p harus dipromosikan ke sub kulit 5d yang diikuti dengan pembentukan orbital hibrida sp3d.
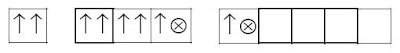
Setelah mengalami hibridisasi dihasilkan.
Dua elektron yang tidak berpasangan tersebut dipakai untuk berikatan dengan flour. Xe (dalam XeF2)
2. Halogen
Unsur-unsur halogen dalam sistem periodik menempati golongan VIIA yang terdiri dari unsur Fluor (F), Klor (Cl), Brom (Br), Yod (I), dan Astatin (At). Unsur-unsur golongan VIIA disebut unsur halogen artinya pembentuk garam. Pada belahan ini unsur Astatin tidak dibahas lantaran bersifat radioaktif dengan waktu paruh pendek sehingga jarang ditentukan dan sifat-sifatnya belum banyak diketahui.
a. Sifat-Sifat Fisis / Fisika Halogen
Sifat-sifat halogen berubah secara periodik menyerupai terlihat pada Tabel berikut.
Tabel 2. Sifat-Sifat Fisis Halogen
Sifat | Fluor | Klor | Brom | Yod |
• Nomor atom (Z) | 9 | 17 | 35 | 53 |
• Konfigurasi elektron | [He]2s2p5 | [Ne]3s23p5 | [Ar]3d104s24p5 | [Kr]4d105s25p5 |
• Titik cair (°C) | –220 | –101 | –7 | 114 |
• Titik didih (°C) | –188 | –35 | 59 | 184 |
• Rapatan (g/cm3) | 1,69 × 10–3 | 3,21 × 10–3 | 3,12 | 4,93 |
• Energi pengionan tingkat pertama (Kj mol–1) | 1681 | 1251 | 1140 | 1008 |
•Afinitas elektron (Kj mol–1) | –328 | –349 | –325 | –295 |
•Kelektronegatifan (skala Pauling) | 4,0 | 3,0 | 2,8 | 2,5 |
•Potensial reduksi standar (volt) X2 + 2e– → 2X– | 2,87 | 1,36 | 1,06 | 0,54 |
•Jari-jari kovalen, | 0,64 | 0,99 | 1,14 | 1,33 |
•Jari-jari ion (X–), | 1,19 | 1,67 | 1,82 | 2,06 |
•Energi Ikatan X-X (Kj mol–1) | 155 | 242 | 193 | 151 |
1) Wujud halogen
Unsur halogen berupa molekul diatomik (X2) dengan energi ikatan X - X berkurang dari Cl2 sampai I2, sesuai dengan pertambahan jari-jari atomnya. Semakin panjang jari-jari atom semakin lemah ikatan antar atom sehingga semakin gampang diputuskan karenanya energi ikatan makin rendah. Energi ikatan F - F lebih kecil dibanding dengan energi ikatan Cl - Cl dan Br - Br, hal ini berafiliasi dengan kereaktifan F2. Semakin reaktif molekul X2 menyebabkan ikatan semakin gampang diputuskan sehingga energi ikatan relatif kecil.
2) Titik Cair dan Titik Didih
Titik cair dan titik didih halogen meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar molekul halogen sesuai bertambahnya massa molekul relatif (Mr). Sesuai titik cair dan titik didihnya, maka wujud halogen pada suhu kamar bervariasi, F2 dan Cl2 berupa gas, Br2 air, dan I2 padat.
3) Warna Halogen
Unsur-unsur halogen sanggup dikenali dari busuk dan warnanya lantaran berbau merangsang. Fluor berwarna kuning muda, klor hijau kekuningan, Brom cokelat, dan yod berwarna ungu.
4) Kelarutan
Kelarutan halogen dari fluor hingga yod dalam air semakin berkurang. Fluor selain larut juga bereaksi dengan air.
2F2(g) + 2H2O(l) → 4HF(aq) + O2(g)
Yod sukar larut dalam air, tetapi gampang larut dalam larutan yang mengandung ion I– karena membentuk ion poliiodida I3–, misalnya I2 larut dalam larutan KI.
I2(s) + KI(aq) → KI3(aq)
Karena molekul halogen nonpolar sehingga lebih gampang larut dalam pelarut nonpolar, misalnya CCl4, aseton, kloroform, dan sebagainya.
b. Sifat-Sifat Kimia Halogen
1) Kereaktifan
Unsur-unsur halogen ialah unsur-unsur yang reaktif, hal ini terbukti keberadaan halogen di alam sebagai senyawa. Kereaktifan halogen dipengaruhi kelektronegatifannya. Semakin besar kelektronegatifan semakin reaktif lantaran semakin gampang menarik elektron. Selain dipengaruhi keelektronegatifan, kereaktifan halogen juga dipengaruhi oleh energi ikatan halogen. Semakin kecil energi ikatan halogen, semakin gampang diputuskan ikatan tersebut sehingga makin reaktif halogen. Dengan melihat data keelektronegatifan dan energi ikat halogen, sanggup disimpulkan kereaktifan halogen dari atas ke bawah semakin berkurang.
Kereaktifan halogen ini sanggup dibuktikan dengan reaksi halogen dengan banyak sekali senyawa atau unsur lain.
a. Halogen sanggup bereaksi dengan sebagian besar logam menghasilkan halida.
2Na(s) + Cl2(g) → 2NaCl(s)
Sn(s) + Cl2(g) → SnCl4(s)
Zn(s) + F2(g) → ZnF2(s)
b. Halogen sanggup bereaksi dengan air.
Reaksi Fluor dengan air menghasilkan HF dan gas oksigen, sedangkan halogen lainnya bereaksi dengan air berdasarkan reaksi:
X2 + H2O → HX + HXO
c. Halogen sanggup bereaksi dengan hidrogen menghasilkan asam halida.
H2(g) + Cl2(g) → 2HCl(g)
d. Halogen sanggup bereaksi dengan hidrokarbon (alkana, alkena, dan alkuna).
Reaksinya dengan alkana ialah reaksi substitusi, sedangkan reaksinya dengan alkena dan alkuna ialah reaksi adisi.
e. Halogen sanggup bereaksi dengan basa.
Cl2(g) + 2NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
Bila larutan NaOH dipanaskan akan dihasilkan NaCl dan NaClO3.
f. Halogen sanggup bereaksi dengan halogen lainnya.
3F2 + Cl2 → 2ClF3
2) Daya Oksidasi Halogen
Halogen merupakan oksidasi kuat. Sifat oksidator halogen dari atas ke bawah semakin lemah, sehingga halogen-halogen sanggup mengoksidasi ion halida di bawahnya.
- F2 + 2KCl → 2KF + Cl2 atau ditulis F2 + 2Cl– → 2F– + Cl2
- Cl2 + 2I– → 2Cl– + I2
- Br2 + KF ↛ (tidak terjadi reaksi) atau ditulis Br2 + F– ↛ (tidak terjadi reaksi)
Dari reaksi di atas juga berarti ion holida (X–) bersifat reduktor. Sifat reduktor ion halida makin ke bawah semakin kuat. Agar lebih memahami daya oksidasi halogen dan daya reduksi ion halida, lakukan aktivitas berikut!
Percobaan / Praktikum Daya Pengoksidasi Halogen terhadap Fe2+ dan Gaya Pereduksi (1) :
Alat dan Bahan:
- Tabung reaksi
- Rak tabung reaksi
- Pipet tetes
- Larutan klor
- Larutan brom
- Larutan yod
- Larutan FeSO4 0,1 M
- Larutan Fe(SO4)3 0,1 M
- Larutan KBr 0,1 M
- Larutan KI 0,1 M
- Larutan KSCN 0,1 M
Langkah kerja :
Membedakan ion Fe2+ dengan ion Fe3+
- Masukkan 1 tetes larutan FeSO4 0,1 M ke dalam tabung reaksi I dan larutan Fe2(SO4)3 0,1 M dalam tabung reaksi II!
- Tambahkan 1 tetes larutan KSCN 0,1 M ke dalam masing-masing tabung!
Hasil Pengamatan :
Larutan | Perubahan warna sehabis penambahan larutan KSCN |
FeSO4 | ... |
F | ... |
Daya Pengoksidasi Halogen
- Masukkan 15 tetes larutan klor ke dalam tabung reaksi I,15 tetes larutan brom ke dalam tabung reaksi II, dan 15 tetes larutan iodium ke dalam tabung reaksi III!
- Tambahkan 15 tetes larutan FeSO4 0,1 M ke dalam masing-masing tabung!
- Ujilah ion Fe3+ dengan menambahkan 15 tetes larutan KSCN 0,1 M ke dalam tiap tabung reaksi!
Hasil Pengamatan:
Larutan | Perubahan warna sehabis penambahan | |
Larutan FeSO4 | Larutan FeSO4 + larutan KSCN | |
Cl2 | .... | .... |
Br2 | .... | .... |
I2 | .... | .... |
Daya Pereduksi Halida
- Masukkan masing-masing 15 tetes larutan Fe2(SO4)3 0,1 M ke dalam tiga tabung reaksi yang berbeda!
- Tambahkan 15 tetes larutan NaCl 0,1 M ke dalam tabung I, 15 tetes larutan KBr 0,1 M ke dalam tabung II, dan 15 tetes KI 0,1 M ke dalam tabung III!
Hasil Pengamatan :
Warna larutan Fe2(SO4)3 | Ditambah larutan | Perubahan yang terjadi |
.... | NaCl | .... |
.... | KBr | .... |
.... | KI | .... |
Pertanyaan:
1. a. Bagaimana urutan daya pengoksidasi Cl2, Br2 dan I2?
b. Bagaimana urutan daya pereduksi Cl–, Br–, dan I–?
2. Dapatkah reaksi berikut menghasilkan halogen?
a. F2 + NaCl →
b. F2 + KBr →
c. Br2 + NaCl →
d. I2 + KF →
e. Cl2 + KBr → Bernard Courtois (1777– 1838)
Courtois lahir di Dijon, Prancis pada tanggal 8 Februari 1777 dan meninggal di Paris pada tanggal 27 September 1838. Ia ialah andal kimia Prancis penemu iodium. Pada tahun 1811 Courtois banyak menambahkan asam pada bubuk ganggang laut. Dari bubuk timbul uap berwarna ungu lembayung yang sanggup mengembun menjadi kristal hitam mengkilat. Kristal ini merupakan unsur gres yang oleh Sir Humphrey Davy diberi nama yod (yodium). Sejak itu nama Courtois menjadi terkenal.
3. Alkali
Alkali merupakan unsur-unsur golongan IA kecuali hidrogen, yang mencakup litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs), dan fransium (Fr).
a. Sifat Fisis Alkali
Secara umum sifat fisis unsur-unsur alkali menyerupai yang tertera pada Tabel 2. berikut.
Tabel 2. Sifat Fisika Logam Alkali (Tak Termasuk Fransium)
Li | Na | K | Rb | Cs | |
•titik leleh, °C | 181 | 98 | 64 | 39 | 29 |
•titik didih, °C | 1.336 | 881 | 766 | 694 | 679 |
•rapatan, g/cm3 | 0,54 | 0,97 | 0,87 | 1,53 | 1,88 |
•distribusi elektron | 2.1 | 2.8.1 | 2.8.8.1 | 2.8.18.8.1 | 2.8.18.18.8.1 |
•energi pengionan, eV | 5,4 | 5,1 | 4,3 | 4,2 | 3,9 |
•jari-jari atom, Å | 1,34 | 1,54 | 1,96 | 2,16 | 2,35 |
•jari-jari ion, Å | 0,60 | 0,95 | 1,33 | 1,48 | 1,69 |
•kelektronegatifan | 1,0 | 0,9 | 0,8 | 0,8 | 0,7 |
•potensial reduksi standar (volt) | –3,05 | –2,71 | –2,92 | –2,49 | –3,02 |
•struktur kristal | bcc | bcc | bcc | bcc | bcc |
1) Wujud Alkali
Alkali merupakan unsur logam yang lunak dan sanggup diiris. Dari data kekerasan (skala Mohs) terlihat dari atas ke bawah semakin berkurang, hal ini berarti makin ke bawah semakin lunak.
2) Titik didih dan Titik Cair Alkali
Logam-logam alkali mempunyai titik didih dan titik cair yang rendah dan cukup lunak. Hal ini disebabkan lantaran atom-atom logam alkali mempunyai satu elektron valensi sehingga gaya yang mengikat partikel-partikel terjejal relatif lemah.
3) Energi Ionisasi (Energi Pengion) Alkali
Energi ionisasi logam-logam alkali relatif rendah dibanding energi ionisasi logam-logam lain. Hal ini memperlihatkan bahwa logam alkali lebih gampang melepaskan elektron daripada logam lainnya. Energi ionisasi logam alkali dari atas ke bawah makin rendah, sehingga dari litium hingga sesium semakin reaktif.
4) Potensial Reduksi Standar Alkali
Harga potensial reduksi standar kecuali litium dari atas ke bawah semakin negatif. Hal ini memperlihatkan semakin mudahnya melepas elektron (sifat reduktor semakin berpengaruh dari Na hingga Cs). Penyimpangan harga potensial reduksi (E°) pada litium disebabkan lantaran energi hidrasi Li jauh lebih besar daripada alkali yang lain sehingga potensial reduksi Li paling negatif.
b. Sifat Kimia Alkali
Unsur-unsur alkali merupakan golongan logam yang paling reaktif. Kereaktifan logam alkali dari atas ke bawah semakin bertambah, hal ini disebabkan energi ionisasinya dari atas ke bawah semakin rendah sehingga semakin gampang melepaskan elektron.
Kereaktifan logam alkali sanggup dibuktikan dengan kemampuan bereaksinya dengan banyak sekali unsur lain dan senyawa.
1) Unsur Alkali sanggup Bereaksi dengan Air
Reaksi unsur alkali dengan air menghasilkan basa dan gas hidrogen. Secara umum sanggup dituliskan sebagai berikut:
2M(s) + 2H2O(l) → 2MOH(aq) + H2(g)
Reaksi natrium dengan air sangat hebat, sehingga jika mereaksikan logam natrium dengan air logam natrium harus dipotong sekecil mungkin semoga tidak terjadi ledakan dan jangan sekali-kali memegang logam natrium lantaran sanggup bereaksi dengan air/keringat pada tangan Anda.
Agar lebih memahami reaksi alkali dengan air, lakukan aktivitas berikut.
Percobaan / Praktikum Kereaktifan Beberapa Logam Alkali dan Alkali Tanah (2) :
Tujuan:
Mempelajari keaktifan beberapa logam alkali dan alkali tanah.
Alat dan Bahan:
- gelas kimia
- logam natrium (Na)
- pisau
- pisau
- beling arloji
- logam magnesium (Mg)
- tang besi
- logam kalium (K)
- logam kalsium (Ca)
- kertas saring
Langkah Kerja :
- logam kalsium (Ca)
- kertas saring
Langkah Kerja :
- Isi gelas kimia dengan air dua per tiga bagian, tambahkan 2 - 3 PP! Catat apa yang terjadi!
- Dengan memakai tang besi, ambil logam natrium dari botol penyimpan. Dengan memakai kertas saring, absorbsikan minyak tanah dari permukaan logam itu. Amati permukaan dan catat penampilannya!
- Iris logam itu, amati permukaan, dan catat penampilannya!
- Potong logam natrium sebesar kacang hijau dan masukkan potongan itu ke dalam gelas kimia yang berisi air dengan memakai tang besi. Segera tutup gelas itu dengan beling arloji. Perhatikan dan catat apa yang terjadi!
- Ulangi pekerjaan di atas tetapi Na diganti dengan Mg, K, dan Ca!
Hasil Pengamatan:
Logam | Penampilan logam sebelum diiris | Penampilan permukaan irisan logam | Perubahan yang terjadi sehabis logam dimasukkan ke dalam air |
Na | . . . . | . . . . | . . . . |
Mg | . . . . | . . . . | . . . . |
K | . . . . | . . . . | . . . . |
Ca | . . . . | . . . . | . . . . |
Pertanyaan :
- Mengapa logam natrium dan kalium disimpan dalam minyak tanah?
- Mengapa sehabis dimasukkan logam air menjadi berwarna merah?
- Terdengarkah bunyi letupan? Jika terdengar mengapa sanggup terjadi?
- Bandingkan kereaktifan logam-logam alkali dan alkali tanah yang seperiode berdasar percobaan di atas!
2) Reaksi dengan Oksigen.
Logam alkali sanggup bereaksi dengan oksigen membentuk oksidanya. Bila oksigen yang direaksikan berlebihan, natrium sanggup membentuk peroksida, kalium, rubidium dan sesium membentuk superoksida.
4M(s) | + | O2(g) | → | 2M2O(s) | (M = Li, Na, K, Rb, Cs) |
(terbatas) | (oksida) | ||||
2Na(s) | + | O2 | → | Na2O2(s) | |
(berlebihan) | (natrium peroksida) | ||||
M(s) | + | O2 | → | MO2 | (M = K, Rb, Cs) |
(berlebihan) | (superoksida) |
Untuk menghindari reaksi dengan uap air dan gas oksigen di udara, maka logam alkali disimpan dalam minyak tanah.
3) Reaksi dengan Unsur Nonlogam Lainnya (Halogen, Nitrogen, Belerang dan Fosfor)
2M(s) + X2(g) → 2MX(s) (X = F, Cl, Br, I)
6M(s) + N2(g) → 2M3N(s)
2M(s) + S(s) → M2S(s)
3M(s) + P(s) → 2M3P(s)
4. Alkali Tanah
Unsur-unsur alkali tanah dalam sistem periodik menempati golongan IIA. Unsur-unsur alkali tanah terdiri dari berilium (Be), magnesium (Mg), kalsium (Ca), stronsium (Sr), barium (Ba), dan radium (Ra). Disebut alkali tanah lantaran oksida dan hidroksida dalam air bersifat basa (alkalis) dan oksidanya serupa dengan Al2O3 dan oksida logam berat yang semenjak semula dikenal dengan nama tanah.
a. Sifat-Sifat Fisis Alkali Tanah
Unsur-unsur alkali tanah kecuali berilium (Be) semua merupakan logam putih keperakan dan lebih keras dari alkali. Sifat-sifat fisis lainnya tertera dalam Tabel 3.
Tabel 3. Sifat-Sifat Fisika Logam-logam Alkali Tanah (Tak Termasuk Radium)
Be | Mg | K | Rb | Cs | |
•titik leleh, °C | 1,277 | 650 | 850 | 769 | 725 |
•titik didih, °C | 2.484 | 1.105 | 1.487 | 1.381 | 1.849 |
•rapatan, g/cm3 | 1,86 | 1,74 | 1,55 | 2,6 | 3,59 |
•distribusi elektron | 2.2 | 2.8.2 | 2.8.8.2 | 2.8.18.8.2 | 2.8.18.18.8.2 |
•energi pengionan, eV | 9,3 | 7,6 | 6,1 | 5,7 | 5,2 |
•jari-jari atom, | 1,25 | 1,45 | 1,74 | 1,92 | 1,98 |
•jari-jari ion, | 0,31 | 0,65 | 0,99 | 1,13 | 1,35 |
• keelektronegatifan | 1,5 | 1,2 | 1,0 | 1,0 | 0,9 |
•potensial reduksi standar (volt) | –1,85 | –2,37 | –2,87 | –2,89 | –2,91 |
•struktur kristal | hex | hex | fcc | fcc | bcc |
Pada tabel di atas terlihat dengan naiknya nomor atom, jari-jari atom bertambah panjang yang berakibat semakin lemahnya gaya tarik antar atom. Hal ini menimbulkan makin menurunnya titik leleh dan titik didih. Logam alkali tanah mempunyai 2 elektron valensi sehingga ikatan logamnya lebih berpengaruh daripada ikatan logam pada alkali seperiode. Hal ini menimbulkan titik leleh, titik didih, kerapatan, dan kekerasan alkali tanah lebih besar daripada logam alkali seperiode.
b. Sifat-Sifat Kimia Alkali Tanah
Alkali tanah merupakan golongan logam yang reaktif meskipun tidak sereaktif alkali. Kereaktifan logam alkali tanah meningkat dengan semakin meningkatnya jari-jari atom. Alkali tanah sanggup bereaksi dengan hampir semua unsur nonlogam dengan ikatan ion (kecuali berilium yang membentuk ikatan kovalen). Beberapa reaksi alkali tanah dengan senyawa atau unsur lain ialah sebagai berikut.
1) Reaksi dengan Oksigen
Semua logam alkali tanah sanggup bereaksi dengan oksigen membentuk oksida yang gampang larut dalam air.
2M(s) + O2(g) → 2MO(s) M = alkali tanah
Contoh : 2Ba(s) + O2(g) → 2BaO(s)
Bila oksigen berlebih dan pada tekanan tinggi terjadi peroksida.
Ba(s) | + | O2(g) | → | BaO2(s) |
(berlebih) |
Kelarutan oksidanya semakin besar dari atas ke bawah.
2) Reaksi dengan Air
Magnesium bereaksi lambat dengan air, kalsium stronsium, dan barium bereaksi lebih cepat dengan air membentuk basa dan gas hidrogen.
Ca(s) + 2H2O(l) | → | Ca(OH)2(aq) | + | H2(g) |
Kalsium hidroksida |
3) Reaksi dengan Hidrogen
Alkali tanah bereaksi dengan gas hidrogen membentuk hidrida dengan ikatan ion.
T | ||
Ca(s) + H2(g) | → | CaH2(s) |
Kalsium hidroksida |
Hidrida alkali tanah sanggup bereaksi dengan air menghasilkan basa dan gas hidrogen.
CaH2(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
4) Reaksi dengan Nitrogen
Reaksi alkali tanah dengan gas nitrogen membentuk nitrida.
3Mg(s) | + | N2(g) | → | Mg3N2(s) |
Magnesium nitrida |
5) Reaksi dengan asam
Alkali tanah bereaksi dengan asam menghasilkan garam dan gas hidrogen. Reaksi semakin hebat dari atas ke bawah.
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Berilium bersifat amfoter (dapat bereaksi dengan asam dan basa). Reaksi berilium dengan basa berpengaruh ialah sebagai berikut:
Be(s) + 2NaOH(aq) + 2H2O(l) → Na2Be(OH)4(aq) + H2(g)
6) Reaksi dengan Halogen
Semua alkali tanah sanggup bereaksi dengan halogen membentuk garam dengan ikatan ion kecuali berilium. Secara umum sanggup dituliskan :
M + X2 → MX2
Contoh : Ca(s) + Cl2(g) → CaCl2(s)
7) Reaksi Nyala
Pada pemanasan/pembakaran senyawa alkali pada nyala api menimbulkan unsur alkali tereksitasi dengan memancarkan radiasi elektromagnetik sehingga memperlihatkan warna nyala berilium (putih), magnesium (putih), kalsium (jingga merah), stronsium (merah), dan barium (hijau). Agar sanggup mengamati pribadi warna nyala garam alkali dan alkali tanah, lakukan aktivitas berikut.
Praktikum Mengamati Warna Nyala Garam Alkali dan Alkali Tanah (3) :
Alat dan Bahan:
- Tabung reaksi
- Gelas ukur
- Kaca arloji
- Kawat nikrom
- Pemanas spiritus/bunsen
- HCl pekat
- Kristal NaCl, KCl, CaCl2, SrCl2, BaCl2
Langkah Kerja
- Siapkan garam-garam NaCl, KCl, CaCl2, SrCl2, dan BaCl2 dalam beling arloji yang terpisah!
- Tuangkan masing-masing 2 mL HCl pekat pada kedua tabung reaksi!
Hasil Pengamatan:
No. | Garam | Warna Nyala |
1. | NaCl | .... |
2. | KCl | .... |
3. | CaCl2 | .... |
4. | SrCl2 | .... |
5. | BaCl2 | .... |
Pertanyaan :
- Mengapa pembakaran garam alkali dan alkali tanah sanggup memperlihatkan warna?
- Mengapa unsur-unsur alkali dan alkali tanah memperlihatkan warna nyala yang berbeda-beda?
- Apakah warna nyala dari pembakaran garam natrium, kalium, stronsium, dan barium?
c. Kelarutan Basa Alkali Tanah dan Garamnya
Basa alkali tanah berbeda dengan basa alkali, basa alkali tanah ada yang sukar larut. Harga hasil kelarutan (Ksp) dari basa alkali tanah sanggup dilihat pada tabel berikut.
Hidroksida | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
Ksp | 2 x 10–18 | 1,8 x 10–11 | 5,5 x 10–6 | 3,2 x 10–4 | 5 x 10–3 |
Dari data Ksp di atas terlihat harga Ksp dari Be(OH)2 ke Ba(OH)2 makin besar, berarti hidroksida alkali tanah kelarutannya bertambah besar dengan naiknya nomor atom. Be(OH)2 dan Mg(OH)2 sukar larut, Ca(OH)2 sedikit larut, Sr(OH)2 dan Ba(OH)2 mudah larut. Be(OH)2 bersifat amfoter (dapat larut dalam asam dan basa kuat).
Be(OH)2(s) + 2H+(aq) → Be2+ + 2H2O(l)
Be(OH)2(s) + 2H–(aq) → BeO22– + 2H2O(l)
Harga hasil kali kelarutan (Ksp) beberapa garam alkali tanah terlihat dalam tabel berikut.
Kation | Be2+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ |
Anion | |||||
SO4 2– | besar | besar | 9,1 x 10–6 | 7,6 x 10–7 | 1,1 x 10–10 |
CrO4 2– | besar | besar | 7,1 x 10–4 | 3,6 x 10–5 | 1,2 x 10–10 |
CO3 2– | – | 1 x 10–15 | 2,8 x 10–9 | 1,1 x 10–10 | 5,1 × 10–9 |
C2O4 2– | kecil | 8,6 x 10–5 | 2 x 10–9 | 2 x 10–7 | 1,6 x 10–7 |
Dari tabel Ksp di atas terlihat hasil kali kelarutan garam sulfat berkurang dari BeSO4 sampai BaSO4 berarti kelarutan garam sulfatnya dari atas ke bawah semakin kecil. Kelarutan garam kromat dari BeCrO4 sampai BaCrO4. Semua garam karbonatnya sukar larut, semua garam oksalatnya sukar larut kecuali MgC2O4 yang sedikit larut. Untuk lebih memahami kelarutan basa dan garam alkali lakukan aktivitas berikut.
Percobaan Mengidentifikasi Ion Alkali Tanah (4) :
Alat dan Bahan:
- Tabung reaksi dan rak
- Pipet tetes
- Larutan NaOH, Na2SO4, Na2C2O4, K2CrO4 masing-masing 0,1 M.
Langkah Kerja :
- Tetesilah empat larutan yang mengandung kation alkali tanah dalam tabung reaksi yang disediakan oleh guru dengan larutan NaOH 0,1 M!
- Amatilah terjadinya endapan dan catatlah pada tabel pengamatan!.
- Ulangi langkah 1 dan 2 dengan mengganti larutan NaOH dengan larutan-larutan yang tersedia!
Pereaksi | Tabung 1 | Tabung 2 | Tabung 3 | Tabung 4 |
NaOH 0,1 M berlebihan | . . . . | . . . . | . . . . | . . . . |
Na2SO4 0,1 M | . . . . | . . . . | . . . . | . . . . |
K2CrO4 0,1 M | . . . . | . . . . | . . . . | . . . . |
Na2C2O4 0,1 M | . . . . | . . . . | . . . . | . . . . |
Buatlah kesimpulan ion apakah yang terdapat pada masing-masing tabung reaksi!
5. Unsur-Unsur Periode Ke 3 (Ketiga)
Unsur-unsur periode ketiga mempunyai jumlah kulit elektron yang sama, yaitu tiga kulit. Akan tetapi konfigurasi elektron dari masing-masing unsur berbeda, hal ini akan menimbulkan sifat-sifat kimia yang berbeda. Dari kiri ke kanan unsur periode ketiga berturut-turut ialah natrium (Na), magnesium (Mg), aluminium (Al), silikon (Si), fosfor (P), sulfur (S), klor (Cl) dan argon (Ar). Na, Mg, dan Al merupakan unsur logam, Si semilogam, P, S dan Cl nonlogam, Ar gas mulia. Beberapa sifat unsur-unsur periode ketiga diberikan pada Tabel 4 berikut.
Tabel 4. Beberapa Sifat Unsur Periode Ketiga
Unsur | Na | Mg | Al | Si | P | S | Cl | Ar |
Nomor atom | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
Konfigurasi elektron | ||||||||
K | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 8 | 8 | 8 | 8 | 8 | 8 | 8 | 8 |
M | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Energi ionisasi (KJ/mol) | 496 | 738 | 578 | 786 | 1012 | 1000 | 1251 | 1527 |
Titik cair, °C | 97,8 | 649 | 660 | 1410 | 44 | 113 | –101 | –184,2 |
Titik didih, °C | 883 | 1090 | 2467 | 2680 | 280 | 445 | –35 | –185,7 |
Struktur | kristal logam | kristal logam | kristal logam | molekul kovalen raksasa | Molekul poliatom | molekul poliatom | molekul diatom | Molekul monoatom |
Tingkat oksidasi tertinggi | +1 | +2 | +3 | +4 | +5 | +6 | +7 | – |
Afinitas elektron (KJ/mol) | –53 | 230 | –44 | –134 | –72 | –200 | –349 | 35 |
Kelektronegatifan | 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 | – |
a. Sifat-Sifat Fisis Unsur Periode Ke 3
1) Wujud pada Suhu Biasa
Dari titik leleh dan titik didih kita sanggup menyimpulkan bahwa unsur-unsur dari natrium hingga sulfur berwujud padat, sedangkan klor dan argon berwujud gas pada suhu biasa.
2) Titik Leleh dan Titik Didih
Titik leleh dan titik didih unsur periode ketiga dari natrium ke kanan meningkat dan mencapai puncaknya pada silikon, lalu turun. Dari natrium hingga aluminium titik leleh dan titik didih meningkat seiring bertambah kuatnya ikatan logam lantaran bertambahnya jumlah elektron valensi. Silikon mempunyai titik leleh dan titik didih tertinggi lantaran silikon mempunyai struktur kovalen raksasa dimana setiap atom silikon terikat secara kovalen pada empat atom silikon lainnya. Zat dengan struktur menyerupai ini mempunyai titik leleh dan titik didih yang sangat tinggi.
Fosfor, belerang, klor, dan argon mempunyai titik leleh dan titik didih yang relatif rendah lantaran merupakan molekul-molekul nonpolar yang terikat dengan gaya Van der Waals yang relatif lemah. Gaya Van der Waals bergantung pada massa molekul relatifnya. Semakin besar massa molekul relatif semakin berpengaruh gaya Van der Waals, karenanya titik leleh dan titik didih makin tinggi. Massa molekul relatif S8 > P4 > Cl2 > Ar, sehingga sulfur mempunyai titik leleh dan titik didih lebih tinggi dari P4, Cl2, dan Ar.
3) Energi Ionisasi
Secara umum energi ionisasi unsur periode ketiga dari kiri ke kanan meningkat. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P. Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh mempunyai kestabilan yang lebih besar. Susunan elektron valensi dalam orbital menyerupai tercantum di bawah ini:
Karena elektron-elektron dalam orbital dari atom Mg penuh sehingga lebih stabil karenanya energi ionisasi Mg lebih tinggi dari Al, dan elektron-elektron dalam orbital dari atom P setengah penuh sehingga lebih stabil karenanya energi ionisasi P lebih tinggi dari S.
4) Sifat Logam
Sifat logam unsur periode ketiga dari kiri ke kanan semakin berkurang. Dari Na hingga Al merupakan unsur logam dengan titik leleh, titik didih, kerapatan dan kekerasan meningkat, hal ini disebabkan pertambahan elektron valensi yang menimbulkan ikatan logam semakin kuat. Dengan demikian daya hantar listrik (sifat konduktor) juga semakin kuat. Silikon merupakan semilogam (metaloid) bersifat semikonduktor, sedangkan fosfor, sulfur dan klor merupakan nonlogam yang tidak menghantarkan listrik.
Untuk lebih memahami sifat-sifat fisis unsur periode ketiga lakukan aktivitas berikut:
Percobaan Menyelidiki Sifat Logam Unsur-unsur Periode Ketiga (5) :
Alat dan Bahan:
- Kaca arloji
- Kawat
- Penjepit logam
- Unsur aluminium
- Unsur magnesium
- Pisau
- Lampu pijar
- Kertas saring
- Unsur belerang
- Unsur natrium
- Baterai
Langkah Kerja :
- Kertas saring
- Unsur belerang
- Unsur natrium
- Baterai
Langkah Kerja :
- Ambil sepotong natrium dari kawasan penyimpanan dengan penjepit logam dan letakkan pada beling arloji! Bersihkan minyak tanah pada permukaan natrium dengan kertas saring!
- Potonglah sebagian logam natrium (tipis) dan amati permukannya! Perhatikan kilap, warna dan kekerasannya!
- Uji daya hantar listrik natrium yang masih mengkilap!
- Ulangi langkah ke-2 dan 3 untuk magnesium, aluminium, dan belerang!
Hasil pengamatan:
No. | Sifat Unsur | Na | Mg | Al | S |
1. | Wujud | .... | .... | .... | .... |
2. | Warna | .... | .... | .... | .... |
3. | Kekerasan | .... | .... | .... | .... |
4. | Daya hantar listrik | .... | .... | .... | .... |
Pertanyaan :
Manakah yang bersifat logam dan manakah yang non logam pada percobaan Anda?
b. Sifat-Sifat Kimia Unsur Periode Ke 3
1) Sifat Reduktor dan Oksidator
Sesuai dengan fakta bahwa dari kiri ke kanan unsur-unsur periode ketiga semakin sukar melepas elektron serta makin gampang menangkap elektron, sehingga dari natrium hingga klor sifat reduktor berkurang dan sifat oksidator bertambah. Natrium merupakan reduktor berpengaruh dan klor merupakan oksidator kuat.
Kekuatan sifat reduktor dan oksidator sanggup dilihat dari harga potensial elektroda. Semakin besar (positif) harga potensial elektroda semakin gampang mengalami reduksi yang berarti sifat oksidator makin kuat, dan sebaliknya makin kecil (negatif) harga potensial elektroda makin gampang dioksidasi yang berarti sifat reduktor makin kuat.
Na+ + e- → Na | E° = –2,71 volt |
Mg2+ + 2e- → Mg | E° = –2,38 volt |
Al3+ + 3e- → Al | E° = –1,66 volt |
S + 2e- → S2– | E° = –0,51 volt |
Cl2 + 2e- → 2Cl– | E° = +1,36 volt |
Daya pereduksi natrium, magnesium, dan aluminium sanggup dibandingkan dari reaksinya dengan air. Natrium bereaksi hebat dengan air menghasilkan NaOH dan gas hidrogen. Hal ini memperlihatkan bahwa natrium merupakan reduktor kuat.
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Magnesium bereaksi lambat dengan air menghasilkan Mg(OH)2 yang tidak larut dan gas hidrogen.
Mg(s) + 2H2O(l) → Mg(OH)2(s) + H2(g)
Aluminium tidak bereaksi dengan air pada suhu biasa tetapi bereaksi dengan uap air panas menghasilkan Al2O3 dan gas hidrogen.
2Al(s) + 3H2O(g) → Al2O3(s) + 3H2(g)
Karena sifat reduktor yang berpengaruh dari natrium, magnesium, dan aluminium ini, maka ketiga logam tersebut dipakai sebagai reduktor pada banyak sekali proses.
Silikon dan fosfor merupakan reduktor yang lemah sehingga sanggup bereaksi dengan oksidator kuat, contohnya klor dan oksigen.
2Si(s) + 2Cl2(g) → 2SiCl(l)
P4(s) + 6Cl2(g) → 4PCl3(g)
Si(s) + O2(g) → SiO2(s)
P4(s) + 3O2(g) → P4O6(g)
Fosfor selain sebagai reduktor lemah juga merupakan oksidator lemah sehingga sanggup bereaksi dengan reduktor kuat. Belerang mempunyai sifat reduktor yang lebih lemah dari fosfor tetapi mempunyai sifat oksidator yang lebih berpengaruh dari fosfor. Belerang sanggup mengoksidasi hampir semua logam, contohnya dengan besi terjadi reaksi sebagai berikut:
Fe(s) + S(s) → FeS(s)
Belerang sanggup mengoksidasi air menjadi gas oksigen.
S(s) + 2H2O(l) → 2H2S(aq) + O2(g)
Klor merupakan oksidator kuat, sanggup mengoksidasi hampir semua logam, dan nonlogam dan banyak sekali senyawa.
Cl2(g) + Mg(s) → MgCl2(s)
Cl2(g) + H2O(l) → 4HCl(ag) + O2(g)
2) Sifat Asam Basa Hidroksida Unsur Periode Ketiga
Hidroksida unsur periode ketiga terdiri dari NaOH, Mg(OH)2, Al(OH)3, Si(OH)4, P(OH)5, S(OH)6 dan Cl(OH)7. Berdasar energi ionisasinya, jika energi ionisasi unsur periode ketiga rendah ikatan antara unsur periode ketiga dengan –OH ialah ion sehingga dalam air melepaskan ion OH– (bersifat basa).
NaOH → Na+ + OH–
Mg(OH)2 → Mg2+ + OH– NaOH tergolong basa berpengaruh dan gampang larut dalam air, sedangkan Mg(OH)2 meskipun tergolong basa berpengaruh tetapi tidak sekuat NaOH. Al(OH)3 bersifat amfoter, artinya sanggup bersifat sebagai asam sekaligus basa tergantung lingkungannya. Dalam lingungan asam, Al(OH)3 bersifat sebagai basa dan sebaliknya dalam lingkungan basa, Al(OH)3 bersifat sebagai asam.
Al(OH)3(s) | + | H+(aq) | → | Al3+(aq) + 3H2O(l) |
asam | ||||
Al(OH)3(s) | + | OH–(aq) | → | Al(OH)4–(aq) |
basa |
Bila energi ionisasi unsur periode ketiga tinggi ikatan antara unsur periode ketiga dengan –OH merupakan ikatan kovalen, sehingga tidak sanggup melepaskan OH– tetapi melepaskan ion H+ karena ikatan O–H bersifat polar. Dengan demikian Si(OH)4, P(OH)5, S(OH)6, dan Cl(OH)7 bersifat asam.
Si(OH)4 | → | H2SiO3 | + | H2O |
asam silikat | ||||
P(OH)5 | → | H3PO4 | + | H2O |
asam fosfat | ||||
S(OH)6 | → | H2SO4 | + | H2O |
asam sulfat | ||||
Cl(OH)7 | → | HClO4 | + | H2O |
asam perklorat |
Sifat asam dari Si(OH)4 atau H2SiO3 sampai Cl(OH)7 atau HClO4 makin berpengaruh lantaran bertambahnya muatan faktual atom pusat, sehingga gaya tolak terhadap H+ makin berpengaruh karenanya makin gampang melepaskan H+ berarti sifat asam makin kuat. Jadi, sifat asam H2SiO3 < H3PO4 < H2SO4 < HClO4. H2SiO3 dan H3PO4 merupakan asam lemah, sedangkan H2SO4 dan HCl tergolong asam kuat.
6. Unsur-Unsur Transisi
Sebagaimana telah kita pelajari di kelas XI, unsur-unsur transisi ialah unsur-unsur yang pengisisan elektronnya berakhir pada orbital-orbital subkulit d. Pada belahan ini akan kita pelajari unsur transisi periode keempat yang terdiri dari unsur skandium (Sc), titanium (Ti), vanadium (V), kromium (Cr), mangan (Mn), besi (Fe), kobalt (Co), nikel (Ni), tembaga (Cu), dan seng (Zn).
a. Sifat fisis Unsur Transisi
Semua unsur transisi merupakan unsur logam sehingga bersifat konduktor, berwujud padat pada suhu kamar (kecuali Hg), paramagnetik, dan sebagainya. Sifat-sifat unsur transisi periode keempat sanggup dilihat pada Tabel 5. berikut.
Tabel 5. Sifat Fisis Unsur Deret Transisi yang Pertama
Unsur | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
titik leleh, °C | 1.539 | 1.660 | 1.917 | 1.857 | 1.244 | 1.537 | 1.491 | 1.455 | 1.084 | 420 |
titik didih, °C | 2.730 | 3.318 | 3.421 | 2.682 | 2.120 | 2.872 | 2.897 | 2.920 | 2.582 | 911 |
rapatan, g/cm3 | 2,99 | 4,51 | 6,1 | 7,27 | 7,30 | 7,86 | 8,9 | 8,90 | 8,92 | 7,1 |
distribusi elektron | 2.8.9.2 | 2.8.10.2 | 2.8.11.2 | 2.8.13.1 | 2.8.13.2 | 2.8.14.2 | 2.8.15.2 | 2.8.16.2 | 2.8.18.1 | 2.8.18.2 |
energi pengionan, eV | 6,5 | 6,8 | 6,7 | 6,8 | 7,4 | 7,9 | 7,9 | 7,6 | 7,7 | 9,4 |
jari-jari atom, Å | 1,61 | 1,45 | 1,32 | 1,25 | 1,24 | 1,24 | 1,25 | 1,25 | 1,28 | 1,33 |
keelektonegatifan | 1,3 | 1,5 | 1,6 | 1,6 | 1,5 | 1,8 | 1,8 | 1,8 | 1,9 | 1,6 |
struktur kristal | hex | hex | bcc | bcc | sc | bcc | hex | fcc | fcc | hex |
Tabel 6. Sifat Fisika Unsur Deret Transisi Kedua
Unsur | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Mg | Co |
titik leleh, °C | 1.530 | 1.852 | 2.477 | 2.610 | 2.250 | 2.427 | 1.963 | 1.554 | 962 | 321 |
titik didih, °C | 3.304 | 4.504 | 4.863 | 4.646 | 4,567 | 4,119 | 3,727 | 2,940 | 2,164 | 767 |
rapatan, g/cm3 | 4,5 | 6,5 | 8,6 | 10,2 | 11,5 | 12,4 | 12,4 | 12,0 | 10,5 | 5,8 |
struktur kristal | hex | hex | bcc | bcc | hex | hex | fcc | fcc | fcc | hex |
Tabel 7. Sifat fisis Unsur Deret Transisi Kedua
Unsur | Ia | Ht | Ia | W | Re | Os | Ir | Pt | Au | Hg |
titik leleh, °C | 920 | 2,222 | 2,985 | 3,407 | 3,180 | 2,727 | 2,545 | 1,772 | 1,064 | 39 |
titik didih, °C | 3,470 | 4,450 | 5,513 | 5,663 | 5,687 | 5,500 | 4,389 | 3,824 | 2,808 | 357 |
rapatan, g/cm3 | 6,2 | 13,3 | 16,6 | 19,4 | 21,0 | 22,6 | 22,6 | 21,4 | 19,3 | 13,6 |
struktur kristal | hex | hex | bcc | bcc | hex | hex | fcc | fcc | fcc | rmb |
1. Sifat Logam
Kecuali seng logam-logam transisi mempunyai elektron-elektron yang berpasangan. Hal ini lebih memungkinkan terjadinya ikatan-ikatan logam dan ikatan kovalen antar atom logam transisi. Ikatan kovalen tersebut sanggup terbentuk antara elektron-elektron yang terdapat pada orbital d. Dengan demikian, kisi kristal logam-logam transisi lebih sukar dirusak dibanding kisi kristal logam golongan utama. Itulah sebabnya logam-logam transisi mempunyai sifat keras, kerapatan tinggi, dan daya hantar listrik yang lebih baik dibanding logam golongan utama.
2. Titik Leleh dan Titik Didih
Unsur-unsur transisi umumnya mempunyai titik leleh dan titik didih yang tinggi lantaran ikatan antar atom logam pada unsur transisi lebih kuat. Titik leleh dan titik didih seng jauh lebih rendah dibanding unsur transisi periode keempat lainnya lantaran pada seng orbital d-nya telah terisi penuh sehingga antar atom seng tidak sanggup membentuk ikatan kovalen.
3. Sifat Magnet
Pengisian elektron unsur-unsur transisi pada orbital d belum penuh menimbulkan ion-ion unsur transisi bersifat paramagnetik artinya atom atau ion logam transisi tertarik oleh medan magnet. Unsur-unsur dan senyawa-senyawa dari logam transisi umumnya mempunyai elektron yang tidak berpasangan dalam orbital-orbital d. Semakin banyak elektron yang tidak berpasangan, makin berpengaruh sifat paramagnetiknya.
4. Jari-Jari Atom
Tidak menyerupai periode ketiga, jari-jari atom unsur-unsur transisi periode keempat tidak teratur dari kiri ke kanan. Hal ini dipengaruhi oleh banyaknya elektron-elektron 3d yang saling tolak-menolak yang sanggup memperkecil gaya tarik inti atom terhadap elektron-elektron. Akibatnya elektron-elektron akan lebih menjauhi inti atom, sehingga jari-jari atomnya lebih besar.
b. Sifat Kimia Unsur Transisi
1. Kereaktifan
Dari data potensial elektroda, unsur-unsur transisi periode keempat mempunyai harga potensial elektroda negatif kecuali Cu (E° = + 0,34 volt). Ini memperlihatkan logam-logam tersebut sanggup larut dalam asam kecuali tembaga. Kebanyakan logam transisi sanggup bereaksi dengan unsur-unsur non logam, contohnya oksigen, dan halogen.
2Fe(s) + 3O2(g) → 2Fe2O3(s)
Skandium sanggup bereaksi dengan air menghasilkan gas hidrogen.
2Se(s) + 6H2O(l) → 3H2(g) + 2Sc(OH)3(aq)
2. Pembentukan Ion Kompleks
Semua unsur transisi sanggup membentuk ion kompleks, yaitu suatu struktur dimana kation logam dikelilingi oleh dua atau lebih anion atau molekul netral yang disebut ligan. Antara ion sentra dengan ligan terjadi ikatan kovalen koordinasi, dimana ligan berfungsi sebagai basa Lewis (penyedia pasangan elektron).
Contoh :
[Cu(H2O)4]2+
[Fe(CN)6]4–
[Cr(NH3)4 Cl2]+ Senyawa unsur transisi umumnya berwarna. Hal ini disebabkan perpindahan elektron yang terjadi pada pengisian subkulit d dengan pengabsorbsi sinar tampak. Senyawa Sc dan Zn tidak berwarna.
Anda kini sudah mengetahui Sifat-sifat Unsur Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Anda kini sudah mengetahui Sifat-sifat Unsur Kimia. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.