Aplikasi, Kegunaan Sel Volta dalam Kehidupan Sehari-hari, Contoh, Kimia - Berikut ini yakni macam-macam aplikasi sel volta dalam kehidupan sehari-hari.
a. Sel Leclanche atau Sel Kering
Sel kering banyak dipakai pada alat-alat elektronika, pola lampu senter. Sel ini merupakan sel volta primer. Sel kering ditemukan oleh Leclanche, sehingga sering disebut sel Leclanche. Pada sel Leclanche, reaksi oksidasi terjadi pada zink dan reaksi reduksi terjadi pada karbon yang inert. Elektrolitnya yakni pasta yang lembap terdiri dari MnO2, ZnCl2, NHCl dan karbon hitam. Disebut sel kering alasannya yakni dalam sel tidak terdapat cairan yang bebas.
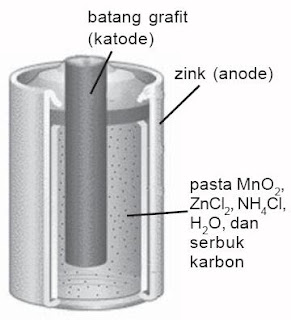 |
| Gambar 1. Sel Leclanche (Microsoft Student 2006) |
Reaksi yang terjadi pada sel Leclanche sanggup ditulis menyerupai berikut.
Anoda | : | Zn(s) → Zn2+(aq) + 2e¯ |
Katoda | : | 2MnO2(s) + 2NH4+(aq) + 2e¯ → Mn2O3(s) + 2NH3(aq) + H2O(l) |
: | Zn(s) + 2MnO2(s) + 2NH4+(aq) → Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l) |
Zn2+ dapat bereaksi dengan NH3 membentuk ion kompleks [Zn(NH3)4]2+.
Potensial tiap sel Leclanche yakni 1,5 volt. Sel Leclanche tidak sanggup diisi ulang, sehingga disebut sel primer. Contoh sel kering antara lain baterai yang biasanya dipakai dalam senter dan baterai berbentuk kancing yang dipakai dalam arloji dan kalkulator.
Sel Leclanche kini sanggup diganti oleh baterai alkalin.
Baterai ini terdiri dari anode zink, katode mangan dioksida, dan elektrolit kalium hidroksida.
Reaksi yang terjadi pada sel Leclanche sanggup ditulis menyerupai berikut.
Anoda | : | Zn(s) + 2OH¯(aq) → Zn(OH)2(s) + 2 e¯ |
Katoda | : | 2 MnO2(s) + 2H2O(l) + 2e¯→ 2MnO(OH)(s) + 2OH¯(aq) |
: | Zn(s) + 2MnO2(s) + 2H2O(l) → Zn(OH)2(s) + 2MnO(OH)(s) |
Potensial dari baterai alkalin yakni 1,5 volt. Kelebihan baterai alkalin dibanding sel Leclance yakni lebih tahan lama.
b. Baterai Perak Oksida
Pernahkah kau mendengar orang menggunakan alat bantu pendengaran? Alat bantu telinga menggunakan baterai perak oksida.
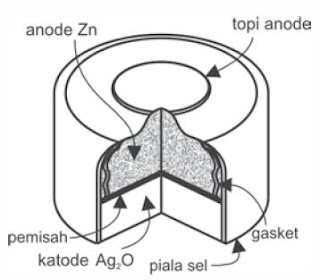 |
| Gambar 2. Baterai Perak Oksida (Sumber: Kimia untuk Universitas) |
Reaksi yang terjadi pada baterai perak oksida menyerupai berikut.
Anoda | : | Ag2O(s) + H2O(l) + 2e¯ → 2 Ag(s) + 2OH¯(aq) |
Katoda | : | Zn(s) + 2OH¯(aq) → Zn(OH)2(s) + 2e¯ |
: | Ag2O(s) + Zn(s) + H2O(l) → 2Ag(s) + Zn(OH)2(s) |
c. Baterai Merkurium (II) Oksida
Baterai ini menggunakan kalium hidroksida sebagai elektrolit dengan voltasenya sekitar 1,4 volt. Anodenya yakni zink dan katodenya biasanya dipakai oksida yang gampang direduksi atau suatu elektrode lamban yang bersentuhan dengan oksida.
d. Aki (Sel Penyimpan Timbal)
Kamu tentu sudah melihat aki. Aki termasuk sel volta sekunder. Aki merupakan sel Volta yang banyak dipakai dalam kendaraan bermotor. Selain itu aki juga sanggup diisi ulang kembali.
Tahukah kau bab dalam aki? Aki disusun dari lempeng timbel (Pb) dan timbel oksida (PbO2) yang dicelupkan dalam larutan asam sulfat (H2SO4). Apabila aki menunjukkan arus maka lempeng timbel Pb bertindak sebagai anode dan lempeng timbel dioksida (PbO2) sebagai katode. Adapun reaksi yang terjadi sebagai berikut.
 |
| Gambar 3. Aki. |
Anoda | : | Pb(s) + SO42¯(aq) → PbSO4(s) + 2e¯ |
Katoda | : | PbO2(s) + 4H+(aq) + SO42¯(aq) + 2e¯ → PbSO4(s) + 2H2O(l) |
: | Pb(s) + PbO2(s) + 4H+(aq) + 2SO42¯(aq) → 2PbSO4(s) + 2H2O(l) E° sel = 2,0 V |
Pada kedua elektrode terbentuk timbel sulfat (PbSO4). Hal ini dikarenakan timbel sulfat terdepositokan pada elektrode di mana garam ini terbentuk, bukannya terlarut ke dalam larutan. Apabila keping tertutup oleh PbSO4 dan elektrolitnya telah diencerkan oleh air yang dihasilkan, maka sel akan menjadi kosong. Untuk mengisi kembali, maka elektron harus dialirkan dalam arah yang berlawanan menggunakan sumber listrik dari luar. Timbal sulfat dan air diubah kembali menjadi timbal, timbal dioksida dan asam sulfat dengan reaksi menyerupai berikut.
Cas ulang | ||
2PbSO (s) + 2H2O(l) | D | Pb(s) + PbO2(s) + 2H2SO4(l) |
Discas |
e. Sel materi bakar
Sel materi bakar telah dipakai pesawat ruang angkasa dalam aktivitas Appolo ke bulan.
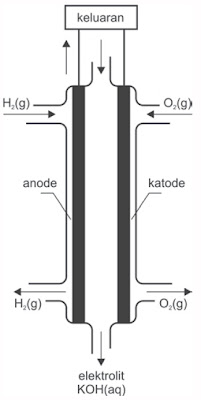 |
| Gambar 4. Skema sel materi bakar. |
Pada sel materi bakar biasanya menggunakan oksigen di katode dan satu gas yang sanggup dioksidasi pada anode. Adapun reaksi yang terjadi pada sel materi bakar adalah:
Anoda | : | 2H2(g) + 4OH¯(aq) → 4H2O(l) + 4e¯ |
Katoda | : | O2(g) + 2H2O(l) + 4e¯ → 4OH¯(aq) |
: | 2H2(g) + O2(g) → 2H2O(l) |
Uap air yang dihasilkan diembunkan dan ditambahkan dalam persediaan air minum untuk para astronot. Sel materi bakar ini mempunyai kelebihan yaitu efisien, sedikit pembakaran, bebas polusi, tidak berisik, dan gampang dibawa.
Sel materi bakar tidak berhenti menunjukkan muatan selama ada sumber materi bakar, biasanya hidrogen dari gas alam dan oksigen dari udara.
Anda kini sudah mengetahui Kegunaan Sel Volta. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.





