Unsur Transisi Periode Ke 4, Keempat, Sifat, Konfigurasi Elektron, Titik Didih dan Leleh, Jari-jari Atom, Logam, Magnet, Bilangan Oksidasi, Warna Ion, Kimia - Kalian tentu sudah tahu besi, nikel, zink (seng) ataupun tembaga. Unsur-unsur tersebut merupakan logam yang sering dijumpai dalam kehidupan sehari-hari. Logam tersebut aneka macam manfaatnya, antara lain dalam bangunan, dan peralatan rumah tangga. Unsur-unsur tersebut tergolong unsur transisi atau logam transisi. Apa saja unsur yang tergolong unsur transisi? Bagaimana sifat-sifatnya dan kelimpahannya?
Marilah kita pelajari lebih lanjut semoga lebih jelas.
A. Anggota Unsur Transisi
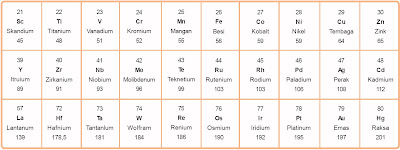
Unsur transisi dalam sistem periodik berada di antara unsur alkali tanah dan unsur golongan boron. Unsur-unsur transisi ialah unsur-unsur blok d di dalam sistem periodik. Perhatikan unsur-unsur transisi dalam tabel berikut.
Tabel 1. Unsur-Unsur Transisi
Keterangan :
Baris 1 = Periode 4
Baris 2 = Periode 5
Baris 3 = Periode 6
Baris 1 = Periode 4
Baris 2 = Periode 5
Baris 3 = Periode 6
Pada tabel di atas unsur transisi dalam (periode 7) tidak diperlihatkan lantaran unsur-unsur tersebut sangat jarang ditemukan dan tidak stabil.
B. Sifat-Sifat Unsur Transisi
Unsur-unsur transisi mempunyai sifat fisika, sifat kimia, dan sifat khusus lainnya.
2.1. Sifat Fisika Unsur Transisi Periode Empat
Sifat-sifat unsur peralihan deret pertama dari Sc hingga Cu ialah mempunyai titik cair yang tinggi, daya hantar listrik yang baik, dan kekerasan yang sedang hingga tinggi. Skandium dan zink berwarna putih, tidak ibarat senyawa unsur lain yang pada umumnya berwarna. Hal ini lantaran skandium dan zink masing-masing mempunyai satu macam bilangan oksidasi yaitu +3 dan +2.
Tabel 2. Sifat Fisika Unsur-Unsur Transisi
Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | |
Nomor atom | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 |
Konfigurasi elektron | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s2 | 3d64s2 | 3d74s2 | 3d74s2 | 3d84s2 | 3d104s2 |
Jari-jari logam (pm) | 161 | 145 | 132 | 127 | 124 | 124 | 125 | 125 | 128 |
Energi ionisasi pertama (kJmol-1) | 631 | 658 | 650 | 653 | 718 | 759 | 758 | 737 | 740 |
Energi ionisasi kedua(kJmol-1) | 1235 | 1310 | 1414 | 1592 | 1509 | 1561 | 1646 | 1753 | 1950 |
Energi ionisasi ketiga(kJmol-1) | 2389 | 2653 | 2828 | 2987 | 3249 | 2457 | 3232 | 3394 | 3554 |
Potensial elektrode (V) | -2,08 | -1,63 | -1,18 | -0,91 | -1,19 | -0,44 | -0,28 | -0,23 | +0,34 |
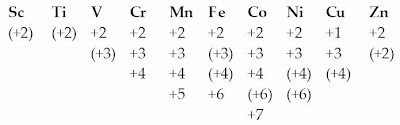
Bilangan oksidasi | 3 | 2,3,4 | 2,3,4,5 | 2,3,6 | 2,3,4,7 | 2,3 | 2,3 | 2 | 1,2 |
Titik didih (°C) | 1397 | 1672 | 1710 | 1900 | 1244 | 1530 | 1495 | 1455 | 1083 |
Kerapatan (gcm-3) | 2,09 | 4,49 | 5,96 | 7,20 | 7,20 | 7,86 | 8,90 | 8,91 | 8,92 |
Kekerasan | - | - | - | 9,0 | 5,0 | 4,5 | - | - | - |
Daya hantar listrik | - | 2 | 3 | 10 | 2 | 17 | 24 | 24 | 97 |
2.1.1. Kecenderungan Periodik Unsur Transisi [1]
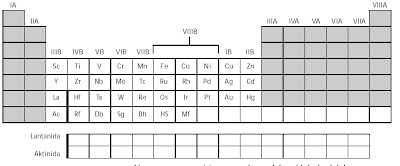
Di antara unsur golongan IIA dan IIIA terdapat sepuluh kolom unsur-unsur golongan B. Unsur-unsur tersebut dinamakan unsur transisi. Istilah transisi artinya peralihan, yaitu peralihan dari blok s ke blok p. Unsur-unsur transisi didefinisikan sebagai unsur-unsur yang mempunyai subkulit d atau subkulit f yang terisi sebagian. Misalnya, tembaga mempunyai konfigurasi elektron [Ar] 4s1 3d10. Unsur-unsur transisi yang lain ditunjukkan pada Gambar 1.
Unsur-unsur transisi yang terdapat dalam blok d ialah unsur-unsur yang mempunyai subkulit d yang belum terisi penuh. Akibatnya, unsur-unsur transisi mempunyai beberapa sifat yang khas, yaitu:
Berdasarkan hukum membangun dari Aufbau, pengisian elektron dalam orbital d mulai terjadi sehabis elektron menghuni orbital 4s2 atau sehabis atom kalsium, 20Ca : [Ar] 4s2. Oleh lantaran itu, unsur-unsur transisi dimulai pada periode keempat dalam tabel periodik, sesuai dengan bilangan kuantum utama terbesar (4s 3d).
Oleh lantaran orbital d maksimum dihuni oleh sepuluh elektron maka akan terdapat sepuluh unsur pada periode keempat, yaitu mulai dari Sc dengan konfigurasi elektron [Ar] 3d1 4s2 sampai dengan Zn dengan konfigurasi elektron [Ar] 3d10 4s2. Konfigurasi elektron unsur-unsur transisi periode keempat sanggup dilihat pada Tabel 3.
Tabel 3. Konfigurasi Elektron Unsur-Unsur Transisi Periode Keempat
Menurut hukum Aufbau, konfigurasi elektron krom ialah [Ar] 3d4 4s2, tetapi faktanya bukan demikian melainkan [Ar] 3d10 4s1. Demikian juga pada konfigurasi elektron atom tembaga, yaitu [Ar] 3d5 4s1. Hal ini disebabkan oleh kestabilan subkulit d yang terisi penuh atau setengah penuh.
2.1.3. Titik Didih dan Titik Leleh [1]
Berdasarkan Tabel 1, kenaikan titik leleh mencapai maksimum pada golongan VB (vanadium) dan VIB (kromium). Hal itu disebabkan oleh kekuatan ikatan antaratom logam, khususnya bergantung pada jumlah elektron yang tidak berpasangan di dalam subkulit d. Pada awal periode unsur transisi, terdapat satu elektron pada orbital d yang tidak berpasangan. Jumlah elektron pada orbital d yang tidak berpasangan meningkat hingga dengan golongan VIB dan VIIB, sehabis itu elektron pada orbital d mulai berpasangan sehingga titik didih dan titik leleh turun.
2.1.4. Jari-Jari Atom
Jari-jari atom memilih sifat-sifat unsur. Pada Tabel 1. tampak bahwa jari-jari atom menurun secara drastis dari skandium (1,44 Å) hingga vanadium (1,22 Å), kemudian berkurang secara perlahan. Penurunan ini akhir dari kenaikan muatan inti yang menarik elektron valensi lebih kuat.
Pada periode yang sama, dari kiri ke kanan jumlah proton bertambah, sedangkan kulit valensi tetap. Akibat bertambahnya jumlah proton, daya tarik muatan inti terhadap elektron valensi bertambah berpengaruh sehingga ukuran atau jari-jari atom semakin kecil.
2.1.5. Sifat Logam [1]
Semua unsur transisi merupakan unsur-unsur logam. Kulit terluar dari unsur-unsur transisi hanya mengandung satu atau dua elektron pada orbital 4s sehingga gampang melepaskan elektron pada kulit terluarnya. Sifat logam dari unsur-unsur transisi lebih berpengaruh bila dibandingkan dengan sifat logam dari golongan utama. Hal ini disebabkan pada unsur-unsur transisi terdapat lebih banyak elektron bebas dalam orbital d yang tidak berpasangan.
Mengapa jumlah elektron yang belum berpasangan sanggup dijadikan ukuran kekuatan logam? Semakin banyak elektron bebas dalam suatu atom logam memungkinkan ikatan antar atom semakin berpengaruh sehingga sifat logam dari unsur itu juga semakin kuat.
Pengaruh positif dari kekuatan ikatan antar atom pada logam transisi tercermin dari sifat kekerasan tinggi, kerapatan tinggi, titik didih dan titik leleh yang juga tinggi, serta sifat hantaran listrik yang lebih baik.
2.2. Sifat Kimia
Di antara unsur golongan IIA dan IIIA terdapat sepuluh kolom unsur-unsur golongan B. Unsur-unsur tersebut dinamakan unsur transisi. Istilah transisi artinya peralihan, yaitu peralihan dari blok s ke blok p. Unsur-unsur transisi didefinisikan sebagai unsur-unsur yang mempunyai subkulit d atau subkulit f yang terisi sebagian. Misalnya, tembaga mempunyai konfigurasi elektron [Ar] 4s1 3d10. Unsur-unsur transisi yang lain ditunjukkan pada Gambar 1.
 |
| Gambar 2. Kecenderungan Periodik Unsur Transisi. |
- Semua unsur transisi ialah logam keras dengan titik didih dan titik leleh tinggi.
- Setiap unsur transisi mempunyai beberapa bilangan oksidasi, kecuali unsur golongan IIB dan IIIB. Misalnya vanadium, mempunyai bilangan oksidasi dari +2 hingga dengan +5.
- Senyawa unsur transisi umumnya berwarna dan bersifat paramagnetik. Semua sifat-sifat akhir dari konfigurasi elektron pada orbital d belum terisi penuh.
Berdasarkan hukum membangun dari Aufbau, pengisian elektron dalam orbital d mulai terjadi sehabis elektron menghuni orbital 4s2 atau sehabis atom kalsium, 20Ca : [Ar] 4s2. Oleh lantaran itu, unsur-unsur transisi dimulai pada periode keempat dalam tabel periodik, sesuai dengan bilangan kuantum utama terbesar (4s 3d).
Oleh lantaran orbital d maksimum dihuni oleh sepuluh elektron maka akan terdapat sepuluh unsur pada periode keempat, yaitu mulai dari Sc dengan konfigurasi elektron [Ar] 3d1 4s2 sampai dengan Zn dengan konfigurasi elektron [Ar] 3d10 4s2. Konfigurasi elektron unsur-unsur transisi periode keempat sanggup dilihat pada Tabel 3.
Tabel 3. Konfigurasi Elektron Unsur-Unsur Transisi Periode Keempat
Nomor Atom | Lambang Unsur | Konfigurasi Elektron | Nomor Golongan pada Tabel Periodik |
21 | Sc | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 | IIIB |
22 | Ti | 1s2 2s2 2p6 3s2 3p6 3d2 4s2 | IVB |
23 | V | 1s2 2s2 2p6 3s2 3p6 3d3 4s2 | VB |
24 | Cr | 1s2 2s2 2p6 3s2 3p6 3d5 4s1 | VIB |
25 | Mn | 1s2 2s2 2p6 3s2 3p6 3d5 4s2 | VIIB |
26 | Fe | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 | VIIIB |
27 | Co | 1s2 2s2 2p6 3s2 3p6 3d7 4s2 | VIIIB |
28 | Ni | 1s2 2s2 2p6 3s2 3p6 3d8 4s2 | VIIIB |
29 | Cu | 1s2 2s2 2p6 3s2 3p6 3d10 4s1 | IB |
30 | Zn | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 | IIB |
Menurut hukum Aufbau, konfigurasi elektron krom ialah [Ar] 3d4 4s2, tetapi faktanya bukan demikian melainkan [Ar] 3d10 4s1. Demikian juga pada konfigurasi elektron atom tembaga, yaitu [Ar] 3d5 4s1. Hal ini disebabkan oleh kestabilan subkulit d yang terisi penuh atau setengah penuh.
2.1.3. Titik Didih dan Titik Leleh [1]
Berdasarkan Tabel 1, kenaikan titik leleh mencapai maksimum pada golongan VB (vanadium) dan VIB (kromium). Hal itu disebabkan oleh kekuatan ikatan antaratom logam, khususnya bergantung pada jumlah elektron yang tidak berpasangan di dalam subkulit d. Pada awal periode unsur transisi, terdapat satu elektron pada orbital d yang tidak berpasangan. Jumlah elektron pada orbital d yang tidak berpasangan meningkat hingga dengan golongan VIB dan VIIB, sehabis itu elektron pada orbital d mulai berpasangan sehingga titik didih dan titik leleh turun.
2.1.4. Jari-Jari Atom
Jari-jari atom memilih sifat-sifat unsur. Pada Tabel 1. tampak bahwa jari-jari atom menurun secara drastis dari skandium (1,44 Å) hingga vanadium (1,22 Å), kemudian berkurang secara perlahan. Penurunan ini akhir dari kenaikan muatan inti yang menarik elektron valensi lebih kuat.
Pada periode yang sama, dari kiri ke kanan jumlah proton bertambah, sedangkan kulit valensi tetap. Akibat bertambahnya jumlah proton, daya tarik muatan inti terhadap elektron valensi bertambah berpengaruh sehingga ukuran atau jari-jari atom semakin kecil.
2.1.5. Sifat Logam [1]
Semua unsur transisi merupakan unsur-unsur logam. Kulit terluar dari unsur-unsur transisi hanya mengandung satu atau dua elektron pada orbital 4s sehingga gampang melepaskan elektron pada kulit terluarnya. Sifat logam dari unsur-unsur transisi lebih berpengaruh bila dibandingkan dengan sifat logam dari golongan utama. Hal ini disebabkan pada unsur-unsur transisi terdapat lebih banyak elektron bebas dalam orbital d yang tidak berpasangan.
Mengapa jumlah elektron yang belum berpasangan sanggup dijadikan ukuran kekuatan logam? Semakin banyak elektron bebas dalam suatu atom logam memungkinkan ikatan antar atom semakin berpengaruh sehingga sifat logam dari unsur itu juga semakin kuat.
Pengaruh positif dari kekuatan ikatan antar atom pada logam transisi tercermin dari sifat kekerasan tinggi, kerapatan tinggi, titik didih dan titik leleh yang juga tinggi, serta sifat hantaran listrik yang lebih baik.
2.2. Sifat Kimia
Unsur transisi mempunyai sifat khas yang berbeda dengan unsur lain. Adapun sifat khasnya antara lain, sebagai berikut.
a. Mempunyai Berbagai Macam Bilangan Oksidasi
Perhatikan konfigurasi elektron dan bilangan oksidasi unsur transisi deret pertama pada Tabel 4. dan Tabel 5.
Tabel 4. Konfigurasi Elektron Unsur Transisi Deret Pertama
Unsur transisi mempunyai elektron pada orbital d. Energi elektron dalam orbital d hampir sama besar. Untuk mencapai kestabilan, unsur-unsur ini membentuk ion dengan cara melepaskan elektron dalam jumlah yang berbeda. Oleh lantaran itu unsur-unsur ini mempunyai dua macam bilangan oksidasi atau lebih dalam senyawanya.
Umumnya, unsur-unsur transisi periode keempat mempunyai biloks lebih dari satu. Hal ini disebabkan tingkat energi orbital s dan orbital d tidak berbeda jauh sehingga memungkinkan elektron-elektron pada kedua orbital itu dipakai melalui pembentukan orbital hibrida sp3d2. [1]
Jika Anda simak Tabel 5, biloks maksimum sama dengan jumlah elektron valensi dalam orbital s dan orbital d atau sama dengan nomor golongan. Jadi, titanium (IVB) mempunyai biloks maksimum +4, vanadium (VB), kromium (VIB), dan mangan (VIIB) mempunyai biloks maksimum berturut-turut +5, +6, dan +7. [1]
Tabel 4. Konfigurasi Elektron Unsur Transisi Deret Pertama
Unsur | Konfigurasi Elektron |
Sc | (Ar) 3d14s |
Ti | (Ar)3d24s2 |
V | (Ar)3d24s2 |
Cr | (Ar)3d54s2 |
Mn | (Ar)3d54s2 |
Fe | (Ar)3d64s2 |
Co | (Ar)3d74s2 |
Ni | (Ar)3d84s2 |
Cu | (Ar)3d104s1 |
Zn | (Ar)3d104s2 |
Unsur transisi mempunyai elektron pada orbital d. Energi elektron dalam orbital d hampir sama besar. Untuk mencapai kestabilan, unsur-unsur ini membentuk ion dengan cara melepaskan elektron dalam jumlah yang berbeda. Oleh lantaran itu unsur-unsur ini mempunyai dua macam bilangan oksidasi atau lebih dalam senyawanya.
Umumnya, unsur-unsur transisi periode keempat mempunyai biloks lebih dari satu. Hal ini disebabkan tingkat energi orbital s dan orbital d tidak berbeda jauh sehingga memungkinkan elektron-elektron pada kedua orbital itu dipakai melalui pembentukan orbital hibrida sp3d2. [1]
Jika Anda simak Tabel 5, biloks maksimum sama dengan jumlah elektron valensi dalam orbital s dan orbital d atau sama dengan nomor golongan. Jadi, titanium (IVB) mempunyai biloks maksimum +4, vanadium (VB), kromium (VIB), dan mangan (VIIB) mempunyai biloks maksimum berturut-turut +5, +6, dan +7. [1]
b. Banyak Senyawaannya Bersifat Paramagnetik
Sifat magnetik suatu zat apakah terdiri atas atom, ion atau molekul ditentukan oleh struktur elektronnya. Interaksi antara zat dan medan magnet dibedakan menjadi dua, yaitu diamagnetik dan paramagnetik. Zat paramagnetik tertarik oleh medan magnet, sedangkan zat diamagnetik tidak.
Banyak unsur transisi dan senyawaannya bersifat paramagnetik. Hal ini disebabkan adanya elektron yang tidak berpasangan. Perkiraan momen magnetik yang disebabkan oleh spin elektron tak berpasangan ditentukan dengan persamaan berikut.

Keterangan:
μ = momen magnetik dalam Bohr Magneton
n = jumlah elektron yang tak berpasangan
1 Bohr magneton (1 B.M) = 9,273 erg/gauss.
Perhatikan harga momen magnetik pada tabel berikut.
Tabel 6. Harga Momen Magnetik
Ion | Jumlah elektron tak berpasangan | Momen berdasarkan perhitungan BM | Momen menurut pengamatan BM | |
V4+ | 1 | 1,73 | 1,7 – 1,8 | |
Cu2+ | 1 | 1,73 | 1,7 – 2,2 | |
V3+ | 2 | 2,83 | 2,6 – 2,8 | |
Ni2+ | 2 | 2,83 | 2,8 – 4,0 | |
Cr3+ | 3 | 3,87 | 3,8 | |
Co2+ | 3 | 3,87 | 4,1 – 5,2 | |
Fe3+ | 4 | 4,90 | 5,1 – 5,5 | |
Co3+ | 4 | 4,90 | 5,4 | |
Mn2+ | 5 | 5,92 | 5,9 | |
Fe3+ | 5 | 5,92 | 5,9 | |
Makin banyak jumlah elektron yang tidak berpasangan, makin besar momen magnetiknya sehingga makin besar sifat paramagnetik. Hubungan ini sanggup kita buat grafik ibarat pada Gambar 5. berikut.
 |
| Gambar 2. Momen Magnetik dan Jumlah Elektron yang Tidak Berpasangan. |
Berdasarkan grafik ini, sanggup kita lihat bahwa dalam satu periode dari kiri ke kanan hingga pada ion Mn2+ momen magnetiknya makin besar, selanjutnya makin berkurang secara teratur. Begitu juga dengan sifat paramagnetiknya.
Contoh Soal Sifat Unsur Transisi [1]
Di antara unsur transisi periode keempat, manakah yang mempunyai sifat magnet?
Jawaban :
Suatu logam akan bersifat magnet bila mempunyai elektron tidak berpasangan. Semakin banyak jumlah elektron yang tidak berpasangan, semakin berpengaruh sifat magnetnya. Berdasarkan klarifikasi tersebut unsur-unsur transisi periode keempat yang mempunyai sifat magnet adalah: Ti, V, Cr, Mn, Fe, Co, Ni.
Kekuatan magnet dari unsur transisi adalah: Cr > Mn > Fe > V > Co.
Contoh Soal Sifat Unsur Transisi [1]
Di antara unsur transisi periode keempat, manakah yang mempunyai sifat magnet?
Jawaban :
Suatu logam akan bersifat magnet bila mempunyai elektron tidak berpasangan. Semakin banyak jumlah elektron yang tidak berpasangan, semakin berpengaruh sifat magnetnya. Berdasarkan klarifikasi tersebut unsur-unsur transisi periode keempat yang mempunyai sifat magnet adalah: Ti, V, Cr, Mn, Fe, Co, Ni.
Kekuatan magnet dari unsur transisi adalah: Cr > Mn > Fe > V > Co.
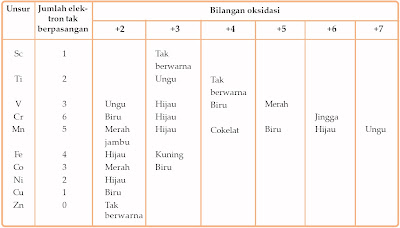
c. Ion Unsur Transisi Berwarna
Berbeda dengan unsur-unsur alkali dan alkali tanah, pada umumnya ion unsur transisi membentuk senyawa berwarna. Beberapa di antaranya sanggup dilihat pada Tabel 7.
Suatu benda atau zat dikatakan berwarna bila ada cahaya yang jatuh kepadanya, khususnya cahaya tampak. Cahaya tampak ialah cahaya yang mempunyai frekuensi berkisar di antara cahaya inframerah dan ultraviolet. Cahaya tampak terdiri atas cahaya merah-kuning-hijau-biru-ungu. [1]
Ion-ion dengan tingkat oksidasi yang berbeda mempunyai warna yang berbeda. Misalnya, perhatikan warna ion unsur mangan pada Tabel 7. di atas.
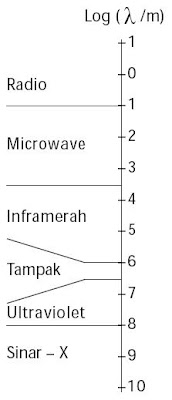 |
| Gambar 3. Spektrum elektromagnetik Cahaya tampak ialah salah satu serpihan dari radiasi elektromagnetik. |
Terjadinya warna pada ion unsur transisi lantaran ion unsur transisi mempunyai elektron yang tidak berpasangan pada subkulit 3d dan elektron-elektron itu terpecah dengan tingkat energi yang berbeda. Elektron-elektron itu tereksitasi dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi dengan menyerap energi. Perubahan tingkat energi ini setara dengan energi cahaya tampak.Adapun pada ion zink tidak berwarna, lantaran orbital d sudah penuh elektron sehingga tidak terjadi perpindahan energi pada orbital d.
d. Unsur-Unsur Transisi sanggup Membentuk Senyawa Kompleks (Senyawa Koordinasi)
Senyawa koordinasi terdiri atas ion logam positif yang disebut juga atom sentra dan sejumlah gugus koordinasi yang disebut ligan.
Ion positif bertindak sebagai asam Lewis dan ligan merupakan basa Lewis. Pada umumnya kation yang sanggup membentuk senyawa kompleks ialah ion-ion unsur transisi, namun dikenal pula beberapa senyawa koordinasi unsur representatif ibarat Mg (III), Ca (II), Al (III), Pb (II), Sn (II), Sn (IV), dan Sb (III).
Ligan yang merupakan basa Lewis sekurang-kurangnya harus mempunyai sepasang elektron bebas dalam orbital ikatan. Perbandingan besarnya ligan dan atom sentra memilih jumlah ligan maksimum yang sanggup diikat. Jumlah ikatan kovalen koordinasi yang sanggup terbentuk pada pembentukan kompleks disebut bilangan koordinasi dari ion pusat. Contohnya ion Cu2+ mempunyai bilangan koordinasi 4 dalam [Cu(H2O)4]2+, [Cu(NH3)4]2+, dan dalam [CuCl4]2¯. Ion Fe3+ mempunyai bilangan koordinasi 6 dalam [Fe(H2O)6]3+, [FeF6]3-, dan dalam [Fe(CN)6]3¯. Adapun Ag+ mempunyai bilangan koordinasi 2 dalam [Ag(NH3)2]+, dan dalam [Ag(CN)2]¯.
Bagaimana hukum penamaan senyawa koordinasi?
Berikut merupakan tata nama senyawa atau ion kompleks berdasarkan IUPAC.
1) Penamaan Ligan
a) Beberapa ligan diberi nama khusus.
Contoh :
NH3 = amin
H2O = aqua
NO = nitrosil
CO = karbonil
b) Logam anion diberi nama yang umum dan diberi akhiran -o.
Contoh :
F¯ = fluoro
Cl¯ = kloro OH¯ = hidrokso
Br¯ = bromo
CO32¯ = karbonato
CH3COO¯ = asetato
C2O42¯ = oksalato
CN¯ = siano
c) Alkil diberi nama ibarat tata nama alkana.
Contoh :
CH3 = metil
C6H5 = fenil
d) Ligan yang memakai nama biasa tanpa diberi spasi
Contoh :
(CH3)2SO4 = dimetilsulfatsida
C5N2N = piridin
(C6H5)3P = trifenilfosfin
e) Ligan N2 dan O2 disebut dinitrogen dan dioksigen
2) Untuk menyebut banyaknya ligan yang sejenis dipakai awalan Yunani (misalnya di-, tri-, tetra-, penta-, heksa-).
3) Nama atom sentra diikuti bilangan oksidasinya yang ditulis dengan angka romawi.
4) Untuk kompleks berupa kation atau molekul netral maka nama atom sentra tidak berubah. Adapun senyawa berupa anion kompleks negatif maka nama atom sentra diakhiri dengan -at).
Contoh :
Kompleks kation :
[Cu(NH3)4]2+ = ion tetraamin tembaga (II)
[Ag(NH3)2]+ = ion diamin perak (I)
[Co(NH3)4Cl2]+ = ion tertraamin diklorokobalt (III)
Kompleks netral :
[Co(NH3)4(H2O)CN]Cl2 = tetraamin aquasianokobalt (II) klorida
[Co(NH3)5CO3]Cl = pentaamin karbonatokobalt (II) klorida
Anda kini sudah mengetahui Unsur Transisi. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Referensi Lainnya :
[1] Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Referensi Lainnya :
[1] Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.