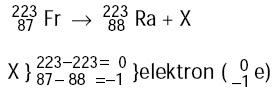Nukleosintesis dan Energi Ikat Inti, Nukleon, Rumus, Contoh Soal, Kimia - Nukleosintesis ialah pembentukan inti atom atau nuklida dari partikel-partikel penyusunnya (proton dan neutron). Energi yang terlibat dalam nukleosintesis dinamakan energi ikat inti (Ei). Lihat Gambar 1. Menurut aspek energitika, suatu inti atom stabil kalau mempunyai energi ikat inti besar. Dengan kata lain, makin besar energi ikat inti, makin stabil inti atom tersebut.
 |
| Gambar 1. Kehilangan massa diubah menjadi energi yang dipakai untuk mengikat nukleon membentuk satu kesatuan di dalam inti. |
Energi ikat inti, Ei didefinisikan sebagai selisih energi antara energi nuklida hasil sintesis dengan energi nukleon penyusunnya. Contoh, nuklida 4He disintesis dari 2 proton dan 2 neutron.
ΔEnukelosintesis = Ei = Enuklida He – E(2p + 2n)
Bagaimana mengukur perubahan energi inti tersebut? Menurut Einstein, perubahan energi inti sanggup ditentukan secara eksklusif dari perubahan massa nukleon, lantaran perubahan massa selalu disertai perubahan energi sesuai persamaan:
E = m . c2 atau ΔE = c2 . Δm
Keterangan :
c = kecepatan cahaya (3 x 108 m s–1)
Δm = perubahan massa (kg)
Tabel 1. Massa Nukleon dan Nuklida dalam Satuan Massa Atom (sma)
| Simbol | Z | A | Massa (sma) |
| β(e–) n p (H) α Li Be B C O Fe Co Pb Po Rn Ra Th Pa U Pu | –1 0 1 1 1 2 2 3 3 4 5 5 6 6 8 26 27 82 82 82 84 86 88 90 90 91 92 92 92 92 94 | 0 1 1 2 3 3 4 6 7 9 10 11 12 13 16 56 59 206 207 208 210 222 226 230 234 234 233 234 235 238 239 | 0,00055 1,00867 1,00728 2,01345 3,01550 3,01493 4,00150 6,01347 7,01435 9,00999 10,0102 11,0066 11,9967 13,0001 15,9905 55,9206 58,9184 205,9295 206,9309 207,9316 209,9368 221,9703 225,9771 229,9837 233,9942 233,9931 232,9890 233,9904 234,9934 238,0003 239,0006 |
| Sumber: General Chemistry , 1990 | |||
Satuan yang dipakai untuk energi ikat inti ialah Mega elektron volt (MeV). Satu Mega elektron volt (1 MeV) sama dengan 1,062 x 10–13 Joule,
atau
1 MeV = 1,062 x 10–13 Joule
Hubungan satuan energi ikat inti dan massa partikel sub inti dalam satuan sma ialah :
1 sma = 931,5 MeV
Contoh Soal Menentukan Perubahan Energi Inti (1) :
Hitung perubahan energi pada pembentukan nuklida helium (partikel alfa) berikut.
a. dalam satuan MeV
b. dalam satuan Joule
Jawaban :
a. Energi ikatan inti dalam satuan Me
Perubahan massa pada pembentukan He:
Δm = mHe – 2 (mn + mp)
Δm = {4,00150 – 2(1,00867 + 1,00728)} sma
Δm = – 0,0304 sma
Ei = (– 0,0304 sma) (931,5 MeV sma–1)
Ei = – 28,3176 MeV
b. Energi ikat inti dalam satuan Joule
1 MeV = 1,062 × 10–13 J
Ei = –28,3176 MeV × 1,062 × 10–13 J MeV–1
Ei = –3,007 × 10–12 J
Jadi, pada pembentukan nuklida He dilepaskan energi sebesar 28,3176 MeV atau 3,007 × 10–12 J.
Kekurangan massa pada pembentukan nuklida helium (Contoh Soal 1. di atas) disebabkan telah diubah menjadi energi yang dipakai untuk mengikat partikel subinti semoga tidak pecah. Oleh lantaran itu, makin besar energi ikat inti makin stabil inti tersebut.
Energi ikat per nukleon bervariasi bergantung pada nomor atom unsur-unsur stabil. Energi ikat rata-rata maksimum sekitar 8,8 MeV dimiliki oleh atom Fe dan Ni, ibarat ditunjukkan pada gambar berikut.
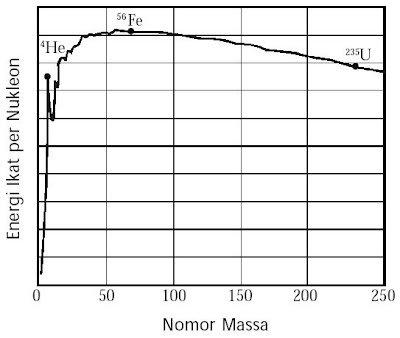 |
| Gambar 2. Grafik Energi ikat nukleon terhadap nomor massa. |
Contoh Soal Menghitung Energi Ikat Inti (2) :
Hitung energi ikat 235U jika massa nuklidanya sebesar 235,034 sma.
Penyelesaian :
Nuklida 235U mengandung 92 proton dan 143 neutron. Massa nukleon penyusun 235U adalah :
92 x 1,00728 sma = 92,6698 sma
143 x 1,00867 sma = 144,2398 sma
Total massa = 236,9096 sma
Kekurangan massa dari nuklida ini ialah :
Massa nukleon = 236,9096 sma
Massa nuklida = 235,0349 sma
Kekurangan massa = 1,8756 sma
Energi ikat inti 235U per nuklida adalah
Ei = 1,8756 sma x 931,5 MeV sma–1 = 1747,1214 MeV
Contoh Soal SPMB 2004 :
Pada inti Fr terjadi reaksi berikut.
X ialah partikel ....
A. neutron
B. proton
C. positron
D. elektron
E. megatron
Pembahasan :
Jadi, X ialah partikel elektron. (D)
Anda kini sudah mengetahui Nukleosintesis. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.