Cara, Proses Pembuatan Aluminium, Proses Hall, Senyawa, Unsur Kimia - Aluminium diperoleh dengan elektrolisis lelehan bauksit Al2O3 dalam kriolit cair Na3AlF6. Kriolit cair diharapkan untuk menurunkan titik leleh bauksit. Proses pembuatan aluminium dikenal dengan proses Hall, lantaran cara ini ditemukan oleh Charles Martin Hall (1863 - 1914) pada tahun 1886.
Proses Hall mencakup dua tahap, yaitu sebagai berikut.
a) Pemurnian Al2O3 dari bauksit
Ke dalam bauksit ditambahkan larutan NaOH pekat sehingga Al2O3 larut sedangkan zat lain tidak larut.
Al2O3(s) + 2NaOH(aq) → 2NaAlO2(aq) + H2O(l)
Larutan NaAlO2 diasamkan sehingga terbentuk endapan Al(OH)3.
NaAlO2(aq) + H2O(l) + HCl(aq) → Al(OH)3(s) + NaCl(aq)
Endapan Al(OH)3 disaring kemudian dipanaskan sehingga terurai menjadi Al2O3 dan uap air.
Panas | ||
Al(OH)3(s) | → | Al2O3(s) + 3H2O(g) |
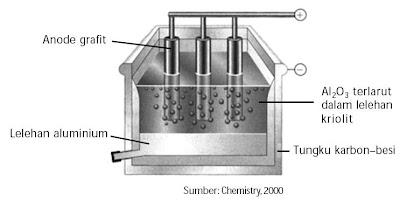
b) Elektrolisis Al2O3 dengan kriolit cair
Al2O3 murni dicampur dengan kriolit Na3AlF6 untuk menurunkan titik leleh Al2O3. Dinding baskom untuk elektrolisis terbuat dari besi yang dilapisi grafit sekaligus sebagai katoda. Sebagai anodanya dipakai batang-batang karbon yang dicelupkan ke dalam campuran.
 |
| Gambar 1. Sel Hall-Heroult untuk pembuatan aluminium dari elektrolisis lelehan Al2O3 (larutan Al2O3 dalam kriolit). |
Larutan Al2O3 dalam kriolit dimasukkan ke dalam sel Hall-Heroult, kemudian dialiri listrik. Ion Al3+ direduksi di katoda menjadi Al cair dan ion O2– dioksidasi di anoda menjadi gas oksigen.
Reaksi yang terjadi:
Al2O3(l) → 2Al3+(l) + 3O2–(l)
Katoda | : | Al3+(l) + 3e– | → | Al(l) | (x 4) | |||
Anoda | : | 2O2–(l) | → | O2(g) | + | 4e– | (x 3) | + |
4Al3+(l) + 6O2–(l) | → | 4Al(l) | + | 3O2(g) | ||||
katoda | anoda |
Gas oksigen yang terbentuk sanggup bereaksi dengan anoda karbon membentuk CO2 sehingga anoda semakin habis dan pada suatu ketika harus diganti.
Berikut ini ialah materi lainnya mengenai Proses Hall [1]
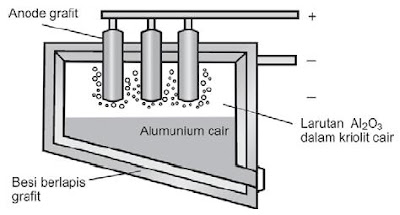
Aluminium dibentuk melalui proses Hall-Héroult, suatu metode komersial pembuatan aluminium melalui elektrolisis aluminium oksida yang dilarutkan dalam lelehan kriolit, Na3AlF6. Campuran kriolit dielektrolisis pada suhu sekitar 950°C. Sel elektrolisis ditunjukkan pada Gambar 2.
Anode karbon dibentuk dari karbonasi minyak bumi yang harus diganti secara kontinu alasannya ialah sering tercemar oleh pengotor. Aluminium dibentuk dalam jumlah besar untuk paduan logam. Logam aluminium murni bersifat lunak dan gampang terkorosi. Penambahan sejumlah kecil logam lain, menyerupai Cu, Mg, atau Mn, aluminium akan menjadi keras dan tahan terhadap korosi.
Beberapa aluminium dipakai untuk mengekstraksi logam lain. Logam kromium diperoleh melalui reduksi oksidanya oleh serbuk aluminium. Reaksi Cr2O3 dengan aluminium bersifat eksotermis.
Cr2O3(s) + 2Al(l) → Al2O3(l) + 2Cr(l) ∆H°= –536 kJ
Reaksi serupa diterapkan pada las listrik untuk menyambung besi, yaitu adonan dari serbuk aluminium dan besi (III) oksida, yang disebut termit. Sekali adonan ini dibakar, reaksi berlangsung terus menghasilkan pijar tinggi bertabur bunga api.
Senyawa aluminium yang penting ialah alumina atau aluminium oksida. Senyawa ini dibentuk melalui pemanasan aluminium hidroksida yang diperoleh dari bauksit dan dilakukan pada 550°C. Alumina membentuk senyawa berpori atau berupa serbuk padat berwarna putih.
Alumina dipakai sebagai katalis, juga dipakai untuk memproduksi logam aluminium. Jika alumina diuapkan pada suhu tinggi (2.045 °C), akan terbentuk corundum yang dipakai sebagai ampelas atau gerinda. Jika alumina diuapkan dengan logam pengotor tertentu, akan diperoleh permata safir atau ruby. Ruby sintesis mengandung 2,5% kromium oksida, Cr2O3 dalam alumina, dan dipakai terutama pada arloji dan sebagai asesoris permata. Dalam air, ion aluminium membentuk kompleks hidrat, Al(H2O)6 3+ dan ion ini gampang terhidrolisis:
[Al(H2O)6]3+(aq) + H2O(l) ⇌ [Al(H2O)5OH]2+(aq) + H3O+(aq)
Aluminium sulfat oktadekahidrat, Al2(SO4)3.18H2O merupakan garam aluminium yang sanggup larut dalam air, dibentuk melalui pelarutan bauksit dalam asam sulfat.
Aluminium sulfat dipakai dalam jumlah besar untuk perekat kertas. Pada proses ini, zat menyerupai lempung dari aluminium sulfat ditambahkan ke dalam fiber selulosa untuk menghasilkan material berpori menjadi halus.
Aluminium sulfat juga dipakai untuk mengolah air limbah dari pulp kertas dan untuk menjernihkan air limbah. Jika basa ditambahkan kepada larutan garam aluminium ini, endapan menyerupai gelatin dari aluminium hidroksida terbentuk.
Al3+(aq) + 3OH–(aq) → Al(OH)3(s)
Ion aluminium mengkoagulasi suspensi koloid yang selanjutnya menyerap endapan aluminium hidroksida. Aluminium hidroksida sering diendapkan ke dalam fiber untuk menyerap celupan tertentu. Aluminium klorida heksahidrat, AlCl3.6H2O dapat dibentuk melalui pelarutan alumina dalam asam klorida. Garam ini dipakai sebagai penghilang amis keringat dan desinfektan.
Garam aluminium tidak berhidrat, AlCl3 tidak sanggup dibentuk melalui pemanasan hidrat alasannya ialah akan terurai menghasilkan HCl. Aluminium klorida tak berhidrat diperoleh melalui reaksi serbuk aluminium dengan gas klorin.
2Al(s) + 3Cl2(g) → 2AlCl3(s)
Padatan AlCl3 diyakini ionis, tetapi kalau dipanaskan pada suhu titik lelehnya akan terbentuk senyawa kovalen Al2Cl6. Aluminium klorida menyublim pada titik lelehnya (180 °C) dan molekul Al2Cl6 terdapat dalam uapnya. Struktur Al2Cl6 merupakan dimer dari AlCl3 dengan klorin sebagai jembatannya.
Pada suhu lebih tinggi, molekul Al2Cl6 berwujud uap akan terdisosiasi menjadi molekul AlCl3 dengan struktur molekul trigonal planar. Aluminium klorida tak berhidrat ini dipakai sebagai katalis, contohnya pada pembuatan etilbenzena.
Anda kini sudah mengetahui Pembuatan Aluminium. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Aluminium dibentuk melalui proses Hall-Héroult, suatu metode komersial pembuatan aluminium melalui elektrolisis aluminium oksida yang dilarutkan dalam lelehan kriolit, Na3AlF6. Campuran kriolit dielektrolisis pada suhu sekitar 950°C. Sel elektrolisis ditunjukkan pada Gambar 2.
Katode | : | 4Al3+(aq) + 12e– → 4Al(l) |
Anode | : | 12O2–(aq) + 3C(s) → 3CO2(g) + 12e– |
Reaksi sel | : | 2[2Al3+ + 3O2–] + 3C(s) → 4Al(l) + 3CO2(g) |
[2Al3+ + 3O2–] = Al2O3 |
Anode karbon dibentuk dari karbonasi minyak bumi yang harus diganti secara kontinu alasannya ialah sering tercemar oleh pengotor. Aluminium dibentuk dalam jumlah besar untuk paduan logam. Logam aluminium murni bersifat lunak dan gampang terkorosi. Penambahan sejumlah kecil logam lain, menyerupai Cu, Mg, atau Mn, aluminium akan menjadi keras dan tahan terhadap korosi.
Beberapa aluminium dipakai untuk mengekstraksi logam lain. Logam kromium diperoleh melalui reduksi oksidanya oleh serbuk aluminium. Reaksi Cr2O3 dengan aluminium bersifat eksotermis.
Cr2O3(s) + 2Al(l) → Al2O3(l) + 2Cr(l) ∆H°= –536 kJ
Reaksi serupa diterapkan pada las listrik untuk menyambung besi, yaitu adonan dari serbuk aluminium dan besi (III) oksida, yang disebut termit. Sekali adonan ini dibakar, reaksi berlangsung terus menghasilkan pijar tinggi bertabur bunga api.
Senyawa aluminium yang penting ialah alumina atau aluminium oksida. Senyawa ini dibentuk melalui pemanasan aluminium hidroksida yang diperoleh dari bauksit dan dilakukan pada 550°C. Alumina membentuk senyawa berpori atau berupa serbuk padat berwarna putih.
∆ | ||
2Al(OH)3(s) | → | Al2O3(s) + 3H2O(l) |
Alumina dipakai sebagai katalis, juga dipakai untuk memproduksi logam aluminium. Jika alumina diuapkan pada suhu tinggi (2.045 °C), akan terbentuk corundum yang dipakai sebagai ampelas atau gerinda. Jika alumina diuapkan dengan logam pengotor tertentu, akan diperoleh permata safir atau ruby. Ruby sintesis mengandung 2,5% kromium oksida, Cr2O3 dalam alumina, dan dipakai terutama pada arloji dan sebagai asesoris permata. Dalam air, ion aluminium membentuk kompleks hidrat, Al(H2O)6 3+ dan ion ini gampang terhidrolisis:
[Al(H2O)6]3+(aq) + H2O(l) ⇌ [Al(H2O)5OH]2+(aq) + H3O+(aq)
Aluminium sulfat oktadekahidrat, Al2(SO4)3.18H2O merupakan garam aluminium yang sanggup larut dalam air, dibentuk melalui pelarutan bauksit dalam asam sulfat.
Aluminium sulfat dipakai dalam jumlah besar untuk perekat kertas. Pada proses ini, zat menyerupai lempung dari aluminium sulfat ditambahkan ke dalam fiber selulosa untuk menghasilkan material berpori menjadi halus.
Aluminium sulfat juga dipakai untuk mengolah air limbah dari pulp kertas dan untuk menjernihkan air limbah. Jika basa ditambahkan kepada larutan garam aluminium ini, endapan menyerupai gelatin dari aluminium hidroksida terbentuk.
Al3+(aq) + 3OH–(aq) → Al(OH)3(s)
Ion aluminium mengkoagulasi suspensi koloid yang selanjutnya menyerap endapan aluminium hidroksida. Aluminium hidroksida sering diendapkan ke dalam fiber untuk menyerap celupan tertentu. Aluminium klorida heksahidrat, AlCl3.6H2O dapat dibentuk melalui pelarutan alumina dalam asam klorida. Garam ini dipakai sebagai penghilang amis keringat dan desinfektan.
Garam aluminium tidak berhidrat, AlCl3 tidak sanggup dibentuk melalui pemanasan hidrat alasannya ialah akan terurai menghasilkan HCl. Aluminium klorida tak berhidrat diperoleh melalui reaksi serbuk aluminium dengan gas klorin.
2Al(s) + 3Cl2(g) → 2AlCl3(s)
Padatan AlCl3 diyakini ionis, tetapi kalau dipanaskan pada suhu titik lelehnya akan terbentuk senyawa kovalen Al2Cl6. Aluminium klorida menyublim pada titik lelehnya (180 °C) dan molekul Al2Cl6 terdapat dalam uapnya. Struktur Al2Cl6 merupakan dimer dari AlCl3 dengan klorin sebagai jembatannya.
Pada suhu lebih tinggi, molekul Al2Cl6 berwujud uap akan terdisosiasi menjadi molekul AlCl3 dengan struktur molekul trigonal planar. Aluminium klorida tak berhidrat ini dipakai sebagai katalis, contohnya pada pembuatan etilbenzena.
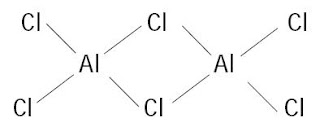 |
| Gambar 3. Struktur dimer dari molekul AlCl3. |
Referensi :
Pangajuanto, T. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 282.
Referensi Lainnya :
[1] Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.