Contoh Ligan Monodentat, Bidentat, Polidentat, Senyawa Kelat, Contoh, Kegunaan, Kimia - Pengertian ligan ialah suatu ion atau molekul yang mempunyai sepasang elektron atau lebih yang sanggup disumbangkan. Ligan merupakan basa lewis yang sanggup terkoordinasi pada ion logam atau sebagai asam lewis membentuk senyawa kompleks. Ligan sanggup berupa anion atau molekul netral [1]. Jika suatu logam transisi berikatan secara kovalen koordinasi dengan satu atau lebih ligan maka akan membentuk suatu senyawa kompleks, dimana logam transisi tersebut berfungsi sebagai atom pusat. Logam transisi mempunyai orbital d yang belum terisi penuh yang bersifat asam lewis yang sanggup mendapatkan pasangan elektron bebas yang bersifat basa lewis. Ligan pada senyawa kompleks dikelompokkan menurut jumlah elektron yang sanggup disumbangkan pada atom logam.
Ligan yang terkoordinasi ke atom logam melalui satu atom saja disebut ligan monodentat, misalnya F-, Cl-, H2O dan CO [2]. Kebanyakan ligan ialah anion atau molekul netral yang merupakan donor elektron. Beberapa ligan monodentat yang umum adalah F-, Cl-, Br-, CN-, NH3, H2O, CH3OH, dan OH-.
Jika ligan tersebut terkoordinasi pada logam melalui dua atom disebut ligan bidentat.Ligan ini populer diantara ligan polidentat. Ligan bidentat yang netral termasuk diantaranya anion diamin, difosfin, dieter.
 |
| Gambar 1. Contoh Ligan Bidentat. |
3. Ligan Polidentat (Senyawa Kelat)
Ligan yang telah dibahas sebelumnya, seperti NH3 dan Cl– dinamakan ligan monodentat (bahasa Latin: satu gigi). Ligan-ligan ini mempunyai atom donor tunggal yang sanggup berkoordinasi dengan atom pusat. Beberapa ligan sanggup mempunyai dua atau lebih atom donor yang sanggup dikoordinasikan dengan ion logam sehingga sanggup mengisi dua atau lebih orbital d ion logam. Ligan menyerupai itu dinamakan ligan polidentat (bahasa Latin: bergigi banyak).
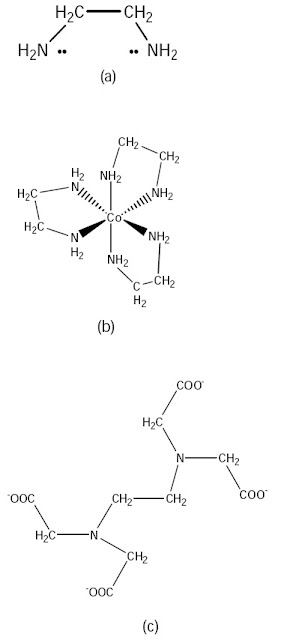 |
| Gambar 2. (a) Struktur etilendiamin (b) Struktur ion kompleks [Co(en)3]3+ (c) Struktur EDTA. |
Oleh sebab ligan polidentat sanggup mencengkeram ion logam dengan dua atau lebih atom donor, ligan polidentat juga dikenal sebagai zat pengkelat. Contoh ligan polidentat menyerupai etilendiamin (disingkat en) dengan rumus struktur pada Gambar 2a.
Ligan en mempunyai dua atom nitrogen, masing-masing dengan sepasang elektron bebas yang siap didonorkan. Atom-atom donor ini harus saling berjauhan biar keduanya sanggup mengkoordinasi ion logam membentuk kompleks dengan posisi berdampingan.
Ion kompleks [Co(en)3]3+ mengandung tiga ligan etilendiamin. Ion kompleks tersebut membentuk struktur koordinasi oktahedral dengan atom kobalt (III) sebagai atom pusatnya (Gambar 2b).
Zat pengkelat menyerupai EDTA pada Gambar 2c sering dipakai dalam analisis kimia, terutama dalam memilih kadar ion kalsium dalam air. Ion EDTA4– memiliki enam atom donor (4 dari gugus COO–, 2 dari atom N). Dengan EDTA, tingkat kesadahan air sanggup diukur. Dalam bidang kedokteran zat pengkelat sering dipakai untuk mengeluarkan ion logam, seperti Hg2+, Pb2+, dan Cd2+. Dalam sistem badan terdapat zat pengkelat, menyerupai mioglobin dan oksihemoglobin.
Contoh Soal UNAS 2004 :
Suatu ion kompleks mempunyai atom pusat Fe3+, dengan ligan molekul H2O dan ion S2O3 2–. Jika bilangan koordinasi = 6 maka rumus ion kompleks tersebut ....
Pembahasan :
Urutan penulisan ion kompleks:
1. atom pusat
2. ligan netral
3. ligan negatif
Muatan atom sentra Fe = 3+ (=biloks Fe)
Kaprikornus jumlah ligan yang diikat = 6 (2 x biloks atom pusat).
Muatan ion kompleks = muatan atom sentra + (4 x muatan H2O) + (2 x muatan S2O3).
Muatan ion kompleks
= 3+ (4 . 0) + (2 . –2)
= 3 + 0 – 4
= -1
Jadi, ion kompleksnya : [Fe(H2O)4(S2O3)2]–1. (D)
Contoh Soal UNAS 2004 :
Suatu ion kompleks mempunyai atom pusat Fe3+, dengan ligan molekul H2O dan ion S2O3 2–. Jika bilangan koordinasi = 6 maka rumus ion kompleks tersebut ....
A. [Fe(H2O)2(S2O3)4]+5
B. [Fe(H2O)5(S2O3)]–2
C. [Fe(H2O)3(S2O3)3]3
D. [Fe(H2O)4(S2O3)2]–1
E. [Fe(H2O)(S2O3)5]–6Pembahasan :
Urutan penulisan ion kompleks:
1. atom pusat
2. ligan netral
3. ligan negatif
Muatan atom sentra Fe = 3+ (=biloks Fe)
Kaprikornus jumlah ligan yang diikat = 6 (2 x biloks atom pusat).
Muatan ion kompleks = muatan atom sentra + (4 x muatan H2O) + (2 x muatan S2O3).
Muatan ion kompleks
= 3+ (4 . 0) + (2 . –2)
= 3 + 0 – 4
= -1
Jadi, ion kompleksnya : [Fe(H2O)4(S2O3)2]–1. (D)
Anda kini sudah mengetahui Ligan. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.





