Pengertian Senyawa Kompleks, Ion, Contoh, Logam, Unsur Transisi, Kimia - Warna yang tampak dalam senyawa kimia tidak hanya menarik, tetapi juga memperlihatkan pengetahuan perihal struktur dan ikatan di dalam senyawa. Logam-logam unsur transisi pada umumnya berwarna sehingga banyak digunakan, contohnya untuk pigmen cat atau kaca. Mengapa senyawa-senyawa logam transisi berwarna dan berubah warnanya jikalau ion atau molekul yang terikat pada logam berubah?
Pertanyaan tersebut sanggup dijawab melalui pembahasan senyawa kompleks dari logam-logam unsur transisi.
1. Senyawa kompleks
Senyawa kompleks ialah senyawa yang tersusun dari suatu ion logam sentra dengan satu atau lebih ligan yang menyumbangkan pasangan elektron bebasnya kepada ion logam pusat. Donasi pasangan elektron ligan kepada ion logam sentra menghasilkan ikatan kovalen koordinasi sehingga senyawa kompleks juga disebut senyawa koordinasi [1]. Kaprikornus semua senyawa kompleks atau senyawa koordinasi ialah senyawa yang terjadi lantaran adanya ikatan kovalen koordinasi antara logam transisi dengan satu atau lebih ligan [2]. Senyawa kompleks sangat bekerjasama dengan asam dan basa lewis dimana asam lewis ialah senyawa yang sanggup bertindak sebagai penerima pasangan bebas sedangkan basa lewis ialah senyawa yang bertindak sebagai penyumbang pasangan elektron [3]. Senyawa kompleks sanggup diuraikan menjadi ion kompleks.
2. Ion Kompleks
Ion kompleks ialah senyawa ionik, di mana kation dari logam transisi berikatan dengan dua atau lebih anion atau molekul netral. Dalam ion kompleks, kation logam unsur transisi dinamakan atom pusat, dan anion atau molekul netral terikat pada atom sentra dinamakan ligan (Latin: ligare, artinya mengikat).
Menurut teori asam-basa Lewis, ion logam transisi menyediakan orbital d yang kosong sehingga berperan sebagai asam Lewis (akseptor pasangan elektron bebas) dan ion atau molekul netral yang mempunyai pasangan elektron bebas untuk didonorkan berperan sebagai basa Lewis.
Contoh ion kompleks adalah [Fe(H2O)6]3+.
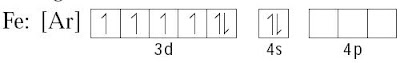
Atom Fe bermuatan 3+ dengan konfigurasi elektron [Ar] 3d5 4s0. Oleh lantaran atom Fe sanggup mengikat enam molekul H2O (netral), atom Fe harus menyediakan enam buah orbital kosong. Hal ini dicapai melalui hibridisasi d2sp3. Proses hibridisasinya ialah sebagai berikut.
Konfigurasi atom Fe :
Konfigurasi dari ion Fe3+ :
Oleh lantaran memerlukan enam orbital kosong, hibridisasi yang terjadi adalah d2sp3, yakni 2 orbital dari 3d, 1 orbital dari 4s, dan 3 orbital dari 4p. Keenam orbital d2sp3 selanjutnya dihuni oleh pasangan elektron bebas dari atom O dalam molekul H2O.
Molekul atau ion yang bertindak sebagai ligan, yang terikat pada atom pusat, sekurang-kurangnya harus mempunyai satu pasang elektron valensi yang tidak digunakan, misalnya Cl–, CN–, H2O, dan NH3, seperti ditunjukkan pada struktur Lewis Gambar 1.
 |
| Gambar 1. (a) Ligan H2O dan (b) NH3. |
Pada pembentukan ion kompleks, ligan dikatakan mengkoordinasi logam sebagai atom pusat. Ikatan yang terbentuk antara atom sentra dan ligan ialah ikatan kovalen koordinasi. Penulisan rumus kimia untuk ikatan koordinasi dalam senyawa kompleks dipakai tanda kurung siku. Jadi, dalam rumus [Cu(NH3)4]SO4 terdiri atas kation [Cu(NH3)4]2+ dan anion SO42–, dengan kation merupakan ion kompleks. Senyawa yang terbentuk dari ion kompleks dinamakan senya a kompleks atau koordinasi.
Ion kompleks mempunyai sifat berbeda dengan atom sentra atau ligan pembentuknya. Misalnya, pada ion kompleks Fe(SCN)2+, ion SCN– tidak berwarna dan ion Fe3+ berwarna cokelat. Ketika kedua spesi itu bereaksi membentuk ion kompleks, [Fe(SCN)6]3– warnanya menjadi merah darah.
Pembentukan kompleks juga sanggup mengubah sifat-sifat ion logam, menyerupai sifat reduksi atau sifat oksidasi. Contohnya, Ag+ dapat direduksi oleh air dengan potensial reduksi standar:
Ag+(aq) + e– → Ag(s) Eo = +0,799 V
Namun ion [Ag(CN)2]– tidak sanggup direduksi oleh air lantaran ion Ag+ sudah dikoordinasi oleh ion CN– menjadi stabil dalam bilangan oksidasi +1.
[Ag(CN)2]–(aq) + e– → Ag(s) Eo = –0,31 V
4. Ligan
5. Tata Nama Senyawa Kompleks
Anda kini sudah mengetahui Senyawa Kompleks dan Ion Kompleks. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
5. Tata Nama Senyawa Kompleks
Anda kini sudah mengetahui Senyawa Kompleks dan Ion Kompleks. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] COTTON, F. A.; WILKINSON G.; 1984: I Lantanoidi, nonchè Scandio e Ittrio.In: S. BRESADOLA, A. PELOSO (Eds): Chimica inorganica, 3rd ed. 23,1010-1033. Casa Editrice Ambrosiana, Milano, Italy.
[2] Sukardjo. 1997. Kimia Fisika. Rineka Cipta. Yogyakarta. p. 155.
[3] Shriver, D.F and P.W.Atkins. 1940. Shriver & Atkins Inorganic Chemistry. W.H. Freeman and Co., c2006. New York. p. 822.