Ciri-ciri Inti Atom Stabil, Nuklida, Grafik, Tabel, Contoh Soal, Kimia - Kestabilan inti atom sanggup ditinjau dari aspek kinetika dan energitika. Kestabilan secara energitika ditinjau dari aspek energi nukleosintesis dihubungkan dengan energi komponen penyusunnya (proton dan neutron), disebut energi ikat inti. Kestabilan secara kinetika ditinjau menurut kebolehjadian inti meluruh membentuk inti yang lain, disebut peluruhan radioaktif.
Untuk mengetahui ciri-ciri inti yang stabil dan inti yang tidak stabil sanggup ditinjau dari perbandingan antarpartikel yang terkandung di dalam inti atom, yaitu perbandingan neutron terhadap proton (N/Z). Selain nuklida 1H, semua nuklida atom mempunyai proton dan neutron. Suatu nuklida dinyatakan stabil kalau mempunyai perbandingan neutron terhadap proton lebih besar atau sama dengan satu (N/Z ≥ 1). Untuk nuklida ringan (Z ≤ 20), perbandingan N/Z @ 1.
Untuk nuklida dengan Z > 20, perbandingan N/Z > 1. Perbandingan N/Z untuk beberapa nuklida yang stabil ditunjukkan pada tabel berikut.
Tabel 1. Beberapa Nuklida yang Stabil
Nuklida | 2H | 20Ne | 40Ca | 64n | 90Sn | 120Nd | 202Hg |
Z | 1 | 10 | 20 | 30 | 40 | 50 | 80 |
N | 1 | 10 | 20 | 34 | 50 | 70 | 122 |
N/Z | 1 | 1 | 1 | 1,13 | 1,25 | 1,50 | 1,50 |
Berdasarkan tabel tersebut, tampak bahwa nilai N/Z berubah sebagai fungsi Z. Hubungan proton dan neutron sanggup diungkapkan dalam bentuk grafik yang disebut grafik pita kestabilan.
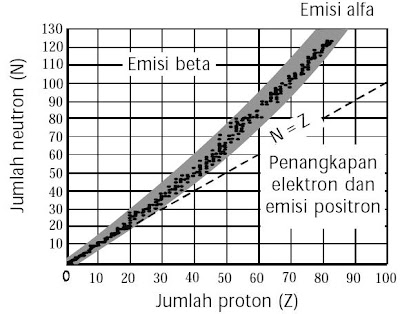 |
| Gambar 1. Grafik pita kestabilan Nuklida stabil ditunjukkan oleh titik hitam yang berkerumun membentang ibarat pita sehingga disebut pita kestabilan. Di luar pita kestabilan tergolong radioaktif. |
Dengan bertambahnya jumlah proton (Z), perbandingan neutron dan proton meningkat sampai 1,5. Kenaikan angka banding N/Z diyakini akhir meningkatnya tolakan muatan positif dari proton. Untuk mengurangi tolakan antarproton dibutuhkan neutron yang berlebih.
Nuklida di luar pita kestabilan umumnya bersifat radioaktif atau nuklida tidak stabil. Nuklida yang terletak di atas pita kestabilan yaitu nuklida yang mempunyai neutron berlebih. Untuk mencapai keadaan inti yang stabil, nuklida ini mengubah neutron menjadi proton dan partikel beta.
Nuklida yang terletak di bawah pita kestabilan yaitu nuklida yang miskin neutron. Untuk mencapai keadaan yang stabil, dilakukan dengan cara memancarkan positron atau penangkapan elektron (electron capture) pada kulit K menjadi neutron. Nuklida yang terletak di atas pita kestabilan dengan nomor atom (jumlah proton) lebih dari 83 yaitu nuklida yang mempunyai neutron dan proton melimpah. Untuk mencapai keadaan stabil, nuklida ini melepaskan sejumlah partikel alfa (inti atom He).
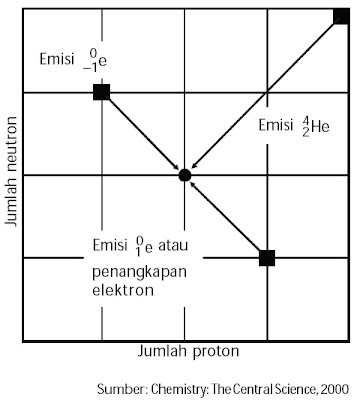 |
| Gambar 2. Semua unsur radioaktif meluruh membentuk unsur yang stabil dengan nomor atom sekitar 50-an. |
Contoh Soal Meramalkan Kestabilan Inti :
Ramalkan apakah nuklida  stabil atau tidak. Jika tidak, bagaimana untuk mencapai stabil?
stabil atau tidak. Jika tidak, bagaimana untuk mencapai stabil?
Jawaban :
Kestabilan inti sanggup dilihat dari angka banding N/Z. Untuk inti dengan jumlah proton (Z) < 20, angka banding N/Z = 1. Angka banding N/Z untuk  = 6/7 = 0,86 lebih kecil dari 1 sehingga tidak stabil.
= 6/7 = 0,86 lebih kecil dari 1 sehingga tidak stabil.
Oleh alasannya yaitu nuklida N berada di bawah pita kestabilan (< 1) maka untuk mencapai stabil dilakukan dengan cara memancarkan positron atau penangkapan elektron kulit K.
Anda kini sudah mengetahui Ciri-ciri Inti Atom Stabil. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Praktis dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.





