Cara, Proses Pembuatan Unsur Golongan VIA, 6A, Senyawa Kimia - Pembuatan unsur golongan 6A dan senyawanya ialah sebagai berikut :
a. Unsur Belerang
Pembuatan welirang pertama kali dikembangkan pada tahun 1904 oleh Frasch yang membuatkan cara untuk mengekstrak welirang yang dikenal dengan cara Frasch. Pada proses ini pipa logam berdiameter 15 cm yang mempunyai dua pipa konsentrik yang lebih kecil ditanam hingga menyentuh lapisan belerang. Uap air yang sangat panas dipompa dan dimasukkan melalui pipa luar, sehingga welirang meleleh, selanjutnya dimasukkan udara bertekanan tinggi melalui pipa terkecil, sehingga terbentuk busa welirang yang keluar mencapai 99,5%.
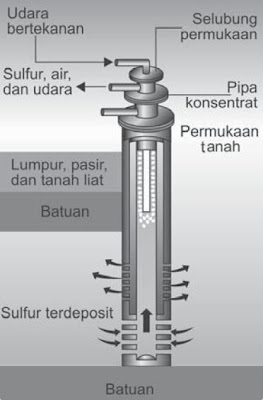 |
| Gambar 1. Pompa Frasch (Sumber: Kamus Kimia Bergambar). |
b. Senyawa Asam Sulfat
Asam sulfat (H2SO4) dibentuk dengan proses kontak. Belerang dibakar dalam udara kering di ruang pembakar pada suhu 100 °C. Gas yang dihasilkan mengandung kurang lebih 10% volume sulfur dioksida. Setelah didinginkan hingga 400 °C, kemudian dimurnikan dengan cara pengendapan elektrostastik. Sulfur dioksida yang terbentuk kemudian dikonversi menjadi SO3 dengan memakai vanadium (V) oksida. Reaksi yang terjadi ialah eksoterm. Reaksi dilakukan pada suhu 450 °C – 474 °C.
2SO2(g) + O2(g) D 2SO3(g) ΔH = -98 kJmol-1
Sulfur trioksida yang dihasilkan didinginkan kemudian dilarutkan dalam H2SO4 98%, sehingga menghasilkan asam 98,5% yang kemudian diencerkan dengan air melalui reaksi berikut ini.
SO3(g) + H2SO4(l) → H2S2O7(l)
H2S2O7(l) + H2O(l) → 2H2SO4(l)
Reaksi keseluruhan sanggup ditulis menyerupai berikut.
H2O(l) + SO3(g) → H2SO4(l)
c. Senyawa Belerang Dioksida
Belerang dioksida (SO2) secara teknik dibentuk dengan cara berikut.
1) SO2 murni diperoleh dari pembakaran belerang.
S(s) + O2(g) → SO2(g)
2) Pemanggangan sulfida.
4FeS2(s) + 11O2(g) → 2FeO3(l) + 8SO2(g)
d. Unsur Oksigen
Oksigen sanggup dibentuk dengan beberapa cara, antara lain menyerupai berikut ini.
1) Penguraian katalik hidrogen peroksida (pembuatan di laboratorium).
2H2O2(g) → 2H2O(l) + O2(g)
2) Penguraian termal senyawa yang mengandung banyak oksigen.
2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)
2KClO3(s) → 2KCl(s) + 3O2(g)
2KNO3(s) → 2KNO2(s) + O2(g)
3) Reaksi antara peroksida dan air
2NaO2(s) + 2H2O(l) → 4NaOH(aq) + O2(g)
Oksigen sanggup dibentuk secara komersial dengan cara menyerupai berikut ini.
1) Distilasi bertingkat udara cair.
2) Elektrolisis air.
Anda kini sudah mengetahui Pembuatan Unsur Golongan VIA. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.





