 |
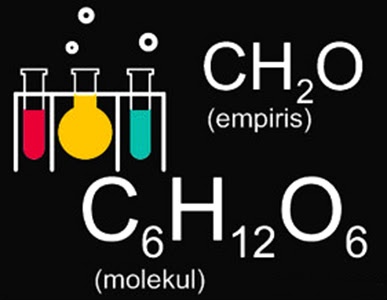
| Rumus Kimia (Empiris dan Molekul) |
Contoh Soal Rumus Empiris dan Rumus Molekul Beserta Pembahasan
Sebelum membagikan beberapa teladan rumus empiris dan rumus molekul, saya akan menjelaskan terlebih dahulu mengenai cara memilih rumus empiris dan cara memilih rumus molekul. Untuk menghitung rumus empiris sebuah senyawa sanggup memakai rumus di bawah ini:
 |
| Rumus Empiris |
Keterangan :
nA = jumlah mol pada unsur A
nB = jumlah mol pada unsur B
mA = massa unsur A
mB = massa unsur B
ArA = massa atom relatif pada unsur A
ArB = massa atom relatif pada unsur B
Baca juga : 45 Contoh Perubahan Kimia Beserta Penjelasan Lengkap
Jika senyawa disusun oleh tiga unsur, maka ketiga unsur tersebut harus dibandingkan semoga memperoleh rumus empirisnya. Dengan begitu teladan soal rumus empiris dan rumus molekul sanggup diselesaikan dengan baik. Secara sistematis terdapat rumus empiris lainnya kalau diketahui tiga unsur pembentuk senyawa yaitu sebagai berikut:
 |
| Rumus Empiris Untuk Tiga Unsur Pembentuk Senyawa |
Keterangan :
nA = jumlah mol pada unsur A
nB = jumlah mol pada unsur B
nC = jumlah mol pada unsur C
mA = massa unsur A
mB = massa unsur B
mC = massa unsur C
ArA = massa atom relatif pada unsur A
ArB = massa atom relatif pada unsur B
ArC = massa atom relatif pada unsur C
Dalam teladan soal rumus empiris dan rumus molekul terdapat perhitungan molekul memakai rumus tertentu. Cara memilih rumus molekul sendiri diperoleh apabila diketahui Mr (massa molekul relatif) dan rumus empiris. Rumus ini intinya yaitu jumlah kelipatan rumus dari empirisnya. Maka dari itu secara sistematis rumus molekul sanggup ditulis menjadi menyerupai di bawah ini:
(Rumus Empiris)n = Rumus MolekulDalam rumus diatas terdapat n yang merupakan bilangan bulat. Kemudian cara memilih nilai n harus diketahui Mr (massa molekul relatif) dan rumus empiris terlebih dahulu. Adapun cara memilih nilai Mr yaitu memakai rumus di bawah ini:
Mr rumus molekul = n x (Mr rumus empiris)
Contoh Soal dan Pembahasan Rumus Empiris/Molekul
Agar anda lebih memahami ihwal rumus kimia ini. Maka saya akan membagikan beberapa teladan soal rumus empiris dan rumus molekul beserta pembahasannya. Berikut misalnya yaitu meliputi:1. Kandungan suatu sampel senyawa terdapat unsur Hidrogen 4 gram dan unsur Oksigen 32 gram. Jika Ar H = 1 dan Ar O = 16, tentukan rumus empirisnya?
Pembahasan
Diketahui : mH = 4 gr; mO =32 gr; ArH = 1; ArO= 16
Ditanyakan : Rumus Empiris = ?
Jawab.
 |
| Jawaban Contoh Soal Rumus Empiris dan Rumus Molekul #1 |
2. Senyawa Hidrokarbon mempunyai kandungan H = 4 gram dan C = 24 gram. Jika massa molekul relatifnya 42 pada rumus molekulnya, maka tentukan rumus molekul senyawa tersebut? (Ar H = 1 dan Ar C = 12)
Baca juga : Sifat Sifat Unsur, Senyawa dan Campuran Beserta Contoh LengkapPembahasan
Diketahui : mH = 4 gr; mC =24 gr; ArH = 1; ArC= 12; Mr rumus molekul = 42
Ditanyakan : Rumus Molekul= ?
Jawab.
Hal pertama yang harus kita lakukan ialah memilih rumus empirisnya terlebih dahulu. Adapun caranya yaitu:
 |
| Jawaban Contoh Soal Rumus Empiris dan Rumus Molekul #2 |
Kemudian menghitung Mr dari rumus empiris senyawa H2C yaitu:
Mr H2C = (2 x Ar H) + (1 x ArC)
Mr H2C = (2 x 1) + (1 x 12) = 14
Setelah itu memilih rumus molekul dengan memakai cara di bawah ini:
Mr rumus molekul = n × (Mr rumus empiris)
42 = n x 14
n = 42/14
n = 3
Rumus molekul = Rumus Empiris x n
= (H2C)3 = H6C3
Kaprikornus rumus molekul senyawa tersebut ialah H6C3.
3. Komposisi senyawa Hidrokarbon terdiri dari unsur karbon 96% dan unsur hidrogen 4%. Apabila Ar C = 12 dan Ar h =1, maka tentukan rumus empiris senyawa tersebut?
Pembahasan
Diketahui :
Unsur Karbon = 96% x 100 = 96 gram
Unsur Hidrogen = 4% x 100 = 4 gram
Ar C = 12 dan Ar h =1
Ditanyakan : Rumus Empiris = ?
Jawab.
 |
| Jawaban Contoh Soal Rumus Empiris dan Rumus Molekul #3 |
Inilah klarifikasi mengenai teladan soal rumus empiris dan rumus molekul beserta pembahasannya. Pada dasarnya rumus Kimia sanggup dibagi menjadi dua bentuk rumus yaitu Empiris dan Molekul. Semoga artikel ini sanggup bermanfaat dan terima kasih telah telah membaca materi Empiris dan Molekul di atas.





