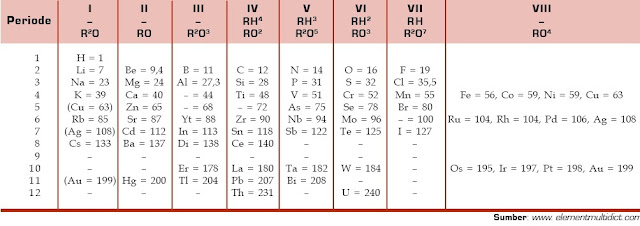
Tabel Sistem Periodik Mendeleev, Kelemahan dan Kelebihan, Unsur Kimia - Pada 1869, ilmuwan Rusia, Dmitri Ivanovic Mendeleev mempublikasikan hasil penelitiannya mengenai pengelompokan unsur-unsur kimia. Unsur-unsur kimia dikelompokkan Mendeleev ke dalam 12 kelompok berdasarkan kenaikan massa atom. Berikut ini ialah tabel periodik Mendeleev.
Pada 1871, Mendeleev memperbaiki tabel periodiknya. Ia memutar 90° posisi tabelnya sehingga menjadi ibarat tabel berikut.
Tabel 1. Tabel Periodik yang Diputar 90° oleh Mendeleev
Unsur-unsur kimia dalam tabel periodik Mendeleev dikelompokkan ke dalam 8 kolom dan 12 baris. Unsur-unsur satu kolom dan satu baris mempunyai sifat kimia yang mirip. Pada tabel tersebut, Mendeleev menyediakan kotak kosong untuk unsur-unsur yang berdasarkan dugaannya akan ditemukan pada masa mendatang. Mendeleev memberi nama unsur-unsur tersebut dengan istilah eka-aluminium (nomor atom 44), eka-boron (nomor atom 68), dan eka-silikon (nomor atom 72).
Dugaan Mendeleev terbukti. Pada bulan November 1875, ilmuwan Prancis Lecoq de Boisbaudran menemukan unsur yang sifatnya sama dengan eka-aluminium, ia menamakan unsur tersebut galium. Perhatikan tabel berikut untuk mengetahui persamaan antara prediksi Mendeleev dan inovasi de Boisbaudran.
Tabel 2. Persamaan Sifat antara Eka-aluminium Menurut Mendeleev dan Galium Menurut de Boisbaudran
Sifat | Eka-aluminium (Ea) | Galium |
Massa atom | Sekitar 68 | 69,72 |
Massa jenis | 6,0 g/cm3 | 5,9 g/cm3 |
Titik leleh | Rendah | 29,78 °C |
Valensi | 3 | 3 |
Metode inovasi | Kemungkinan dari bentuk spektrumnya | Spektroskopi |
Sifat oksida | Rumus: Ea2O3, larut dalam asam dan basa | Rumus: Ga2O3, larut dalam asam dan basa |
Sama halnya dengan eka-aluminium, dua unsur lain yang diprediksi Mendeleev (eka-boron dan eka-silikon) ternyata diketahui mempunyai sifat yang sama dengan skandium dan germanium. Sifat unsur skandium yang ditemukan ilmuwan Swedia, Lars Nilson pada 1879 ibarat dengan eka-boron, sedangkan sifat unsur germanium yang ditemukan ilmuwan Jerman, Clemens Winkler pada 1886 ibarat dengan eka-silikon.
Mendeleev membagi unsur atas 8 golongan dan 12 periode sehingga unsur dalam satu golongan mempunyai sifat yang mirip. Hal penting yang terdapat dalam sistem periodik Mendeleev antara lain sebagai berikut: [1]
a. dua unsur yang berdekatan, massa atom relatifnya mempunyai selisih paling kurang dua atau satu satuan;
b. terdapat kotak kosong untuk unsur yang belum ditemukan, ibarat 44, 68, 72, dan 100;
c. sanggup meramalkan sifat unsur yang belum dikenal ibarat ekasilikon;
d. sanggup mengoreksi kesalahan pengukuran massa atom relatif beberapa unsur, misalnya Cr = 52,0 bukan 43,3.
Berikut ini ialah kelebihan dan kekurangan sistem periodik Mendeleev: [1]
- Sifat kimia dan fisika unsur dalam satu golongan ibarat dan berubah secara teratur.
- Valensi tertinggi suatu unsur sama dengan nomor golongannya.
- Dapat meramalkan sifat unsur yang belum ditemukan pada ketika itu dan telah mempunyai daerah yang kosong.
b. Kekurangan / Kelemahan sistem periodik Mendeleev
- Panjang periode tidak sama dan sebabnya tidak dijelaskan.
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, pola : Te (128) sebelum I (127).
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat.
- Valensi unsur yang lebih dari satu sulit diramalkan dari golongannya.
- Anomali (penyimpangan) unsur hidrogen dari unsur yang lain tidak dijelaskan.
Tokoh Kimia
Dmitri Ivanovic Mendeleev
(1834–1907)
 |
| Dmitri Ivanovic Mendeleev. [2] |
Dmitri Ivanovic Mendeleev (1834–1907) lahir di Tobolsk, Siberia.Ketika kecil, Mendeleev tertarik pada gelas yang diproduksi pabrik milik ibunya. Dari ketertarikan inilah Mendeleev mulai mendalami ilmu Kimia. Pengabdian Mendeleev dalam studi kimia membuatnya berhasil menyusun tabel periodik yang menjadi dasar sistem periodik modern. Ketika menyusun tabel periodiknya Mendeleev menimbang masa setiap unsur dengan teliti. Sebagai penghargaan terhadap jasanya unsur ke- 101 dinamai sesuai namanya, yaitu mendelevium. (Sumber: http:\\en.wikipedia.org)
Anda kini sudah mengetahui Sistem Periodik Mendeleev. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Rahayu, I. 2009. Mudah Belajar Kimia, Untuk Kelas X Sekolah Menengah Atas/Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p 210.
Referensi Lainnya :
[1] Permana, I. 2009. Memahami Kimia 1 : SMA/MA untuk Kelas Semester 1 dan 2. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 175.
[2] http://en.wikipedia.org/wiki/Dmitri_Mendeleev
[2] http://en.wikipedia.org/wiki/Dmitri_Mendeleev