|
| Larutan Elektrolit |
Pengertian Larutan Elektrolit Kuat dan Elektrolit Lemah Beserta Perbedaannya
Larutan elektrolit berpengaruh menyerupai larutan HCl mengandung ion yang cukup banyak sehingga sanggup menciptakan lampu menyala terang. Kemudian larutan elektrolit lemah menyerupai asam asetat mengandung ion yang sedikit sehingga hanya sanggup menciptakan lampu menyala redup. Sedangkan untuk larutan non elektrolit menyerupai sukrosa tidak mengandung ion apapun sehingga tidak sanggup menghantarkan arus listrik. Di bawah ini terdapat klarifikasi mengenai pengertian larutan elektrolit kuat, pengertian larutan elektrolit lemah beserta perbedaan larutan elektrolit berpengaruh dan larutan elektrolit lemah.
Baca juga : Sifat Sifat Unsur, Senyawa dan Campuran Beserta Contoh Lengkap
Larutan Elektrolit Kuat
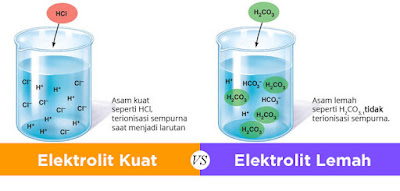
Pengertian larutan elektrolit berpengaruh ialah senyawa yang apabila dilarutkan kedalam air akan mengalami proses ionisasi dengan sempurna. Jenis larutan ini berasal dari beberapa jenis larutan menyerupai basa kuat, garam yang sanggup larut di air dan asam kuat. Contoh elektrolit berpengaruh ialah garam NaCl dimana didalamnya terdapat hasil larutan menyerupai anion dan kation. Apabila garam NaCl ini dilarutkan ke dalam air maka akan menghasilkan ion Na+ serta Cl-. Kemudian adapula pola larutan elektrolit berpengaruh yang berasal dari asam kuat. Asam berpengaruh ini berasal dari penelitian Arrhenius ihwal Asam dan Basa. Berdasarkan pendapatnya, Asam merupakan jenis senyawa yang apabila dilarutkan ke dalam air akan menghasilkan ion H+. Maka dari itu ketika zat asam menyerupai H2SO4, HCl, dan HNO3 larut ke dalam air maka masing masing atomnya akan terionisasi. Proses ionisasi asam yang tepat ini menunjukkan karakteristik asam berpengaruh beserta larutan elektrolit kuat.
Dalam pengertian larutan elektrolit berpengaruh terdapat jenis elektrolit yang berasal dari basa kuat. Jenis elektrolit ini mengandung ion Hidroksida. Ketika basa berpengaruh dilarutkan kedalam air, maka proses ionisasinya akan terjadi secara sempurna. Seperti halnya yang terjadi pada asam kuat. Namun basa berpengaruh menghasilkan ion OH- dan bukan ion H+. Di bawah ini terdapat ciri ciri larutan elektrolit kuat yang mencakup :
- Dapat menghantarkan listrik dengan baik dan kuat.
- Proses ionisasinya sempurna.
- Derajat ionisasi (a) atau tetapannya ialah a = 1.
- Apabla dilakukan pengujian larutan elektrolit berpengaruh maka akan muncul gelembung gas yang banyak serta lampu akan menyala terang.
Larutan Elektrolit Lemah
Pengertian larutan elektrolit lemah ialah senyawa yang apabila dilarutkan kedalam air akan mengalami proses ionisasi sebagian. Maka dari itu larutan elektrolit lemah hanya akan menghasilkan ion yang sedikit didalam air. Larutan ini berasal dari dua jenis larutan yakni basa lemah dan asam lemah. Contoh larutan elektrolit lemah yang berasal asam lemah yaitu HC2K3O2 (Asam Asetat). Ketika asam asetat ini dilarutkan ke dalam air maka tidak akan mengalami proses ionisasi dengan sempurna. Hal ini dikarenakan molekul yang terionisasi menjadi ion hanya 1% dari larutan airnya.
Baca juga : Penjelasan Konfigurasi Elektron Lengkap
Dalam pengertian larutan elektrolit lemah diatas, adapula larutan yang berasal dari basa lemah. Jika basa lemah diarutkan ke dala air maka tidak sanggup terionisasi dengan sempurna. Maka dari itu basa lemah hanya sanggup menghantarkan arus lstrik yang sedikit. Contoh basa lemah yang termasuk ke dalam elektrolit lemah yaitu NH3 (Ammonua). Di bawah ini terdapat ciri ciri larutan elektrolit lemah yang mencakup :
- Dapat menghantarkan listrik yang lemah atau kurang baik
- Proses ionisasinya sebagian.
- Derajat ionisasi (a) atau tetapannya ialah 0 < a < 1.
- Apabla dilakukan pengujian larutan elektrolit lemah, maka akan muncul gelembung gas yang sedikit serta lampu akan menyala redup.
Perbedaan Larutan Elektrolit Kuat dan Larutan Elektrolit Lemah
Selanjutnya saya akan membahas ihwal perbedaan larutan elektrolit berpengaruh dan larutan elektrolit lemah. Berikut penjelasannya:
Elektrolit Kuat
- Proses ionisasinya sempurna.
- Larutannya mengandung ion yang banyak.
- Penghantar listrik yang kuat.
- Mempunyai derajat ionisasi yang mencapai nilai 1.
- Dapat menyalakan lampu dengan terang.
Baca juga : Pengertian, Teori, Sifat Asam dan Basa
Elektrolit Kuat
- Proses ionisasinya tidak tepat atau sebagian.
- Larutannya mengandung ion yang sedikit.
- Penghantar listrik yang lemah.
- Mempunyai derajat ionisasi yang kurang dari 1.
- Dapat menyalakan lampu dengan redup.
Demikianlah klarifikasi mengenai pengertian larutan elektrolit kuat, pengertian larutan elektrolit lemah beserta perbedaan larutan elektrolit berpengaruh dan larutan elektrolit lemah. Semoga artikel ini sanggup bermanfaat. Terima kasih.